
【题目】氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布图是 。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l) =3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1
若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在________(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(3)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
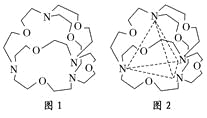
下列分子或离子中,能被该有机化合物识别的是________(填标号)。
a.CF4 b.CH4c.NH4+d.H2O
【答案】(1)![]()
(2)①sp3 ②3 ③d (3)c
【解析】试题分析:(1)根据构造原理可知,基态氮原子的价电子排布图是![]() 。
。
(2)①氨气分子中中心原子氮原子含有1对孤对电子,所以NH3分子的空间构型是三角锥型,NH3中氮原子轨道的杂化类型是sp3。而肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的,所以N2H4分子中氮原子轨道的杂化类型是sp3;
②反应中有4mol N-H键断裂,即有1molN2H4参加反应,生成1.5molN2,则形成的π键有3mol。
③N2H6SO4晶体类型与硫酸铵相同,硫酸铵中有离子键、共价键和配位键,则N2H6SO4晶体内不存在范德华力,答案选d。
(3)要形成氢键,就要掌握形成氢键的条件:一是要有H原子,二是要电负性比较强,半径比较小的原子比如F、O、N等构成的分子间形成的特殊的分子间作用力。符合这样的选项就是c和d,但题中要求形成4个氢键,氢键具有饱和性,这样只有选c


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:

(1)MgCO3溶于稀硫酸的离子方程式是_________________________。
(2)加入H2O2溶液的目的是____________________(用离子方程式表示)。
(3)已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
“沉淀”步骤中,用氨水调节溶液pH的范围是______________________________。
(4)“过滤”所得滤液中存在大量的阳离子有Mg2+、____________。
(5)“结晶”步骤中需蒸发浓缩滤液,使用的仪器有铁架台、酒精灯和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,所得溶液中Fe3+和Fe2+物质的量浓度之比为1:3,则已反应的Fe3+与未反应的Fe3+的物质的量之比是( )
A. 1:1 B. 3:2 C. 2:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应有广泛的用途,实验装置如图所示。
(1)铝热反应是 ________(填“吸热”或“放热”)反应,其能量变化可用下图中的_______(填序号)表示。
反应物的总能量高 | 生成物的总能量高 |
|
|
生成物的总能量低 | 反应物的总能量低 |
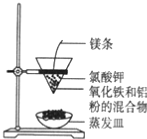
(2)该铝热反应的化学方程式是______________________________________________。
(3)任写出铝热反应在实际生产中的一种用途__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,常用于制备抗凝血药。可以通过下图所示的路线合成:

已知:RCOOH![]() RCOCl;D与FeCl3溶液能发生显色。
RCOCl;D与FeCl3溶液能发生显色。
请回答下列问题:
⑴B→C的转化所加的试剂可能是__________,C+E→F的反应类型是_______。
⑵有关G的下列说法正确的是_________。
A.属于芳香烃 B.能与FeCl3溶液发生显色反应
C.可以发生水解、加成、氧化、酯化等反应 D.1mol G最多可以跟4mol H2反应
⑶E的结构简式为_________。
⑷F与足量NaOH溶液充分反应的化学方程式为__________________________________。
⑸写出同时满足下列条件的E的同分异构体的结构简式_______________。
①发生水解反应②与FeCl3溶液能发生显色反应③苯环上有两种不同化学环境的氢原子
⑹已知:酚羟基一般不易直接与羧酸酯化。而苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:_________________
)是一种重要的有机合成中间体。试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任用)。注:合成路线的书写格式参照如下示例流程图:_________________
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
(1)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出B元素在周期表中的位置为______,属于___区元素,A2+在基态时价电子排布图为__________________。
(2)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。水分子中心原子价层电子对数为____,二氧化碳的VSEPR模型为______,苯分子中碳原子的杂化类型为________。
(3)Co3+有多种配合物,如Co(CN)63-、Co(NH3)4Cl2+ 等。铑(Rh)与钴属于同族元素,某些性质相似。现有铑的某盐组成为CsRh(SO4)2·4H2O,易溶解于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成。该盐中铑离子的配位数为____。请写出该盐溶解于水后的电离方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室利用质子酸甲醇燃料电池作电源,电解硫酸铜溶液。

请回答下列问题:
(1)通入氧气的电极为______(填“正极”或“负极”),通入甲醇一极的电极反应式为_________。
(2)b电极上的现象为________________。
(3)假设硫酸铜溶液的体积为600 mL(电解前后溶液的体积变化忽略不计),若消耗336 mL(标准状况)O2,则电解后硫酸铜溶液的pH为________。
(4)若a、b均换成铜电极,则电解一段时间后硫酸铜溶液的浓度________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】切开后的苹果因被空气氧化而会很快变黄,有人戏称苹果“生锈了”,柠檬汁中含有大量维生素C,把它滴在切面上,可减缓苹果“生锈”。这说明维生素C具有
A.酸性 B.氧化性 C.碱性 D.还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物A、B、C、D有如下转化关系.回答下列问题:

写出反应的化学方程式:②________.⑤______________.
(2)化合物A的结构简式为: 它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:__________;
它是汽油燃烧品质抗震性能的参照物,用系统命名法对A进行命名,其名称为:__________;
(3)篮烷分子的键线式如图所示,试回答:

①写出篮烷分子的化学式__________;
②篮烷分子的一氯取代物的种数为__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com