
| ������ |
| ��ʼ�� |
| ��c |
| ��t |
| ������������ |
| ���ʵ������� |
| 1.2mol |
| 2mol |
| ||
| 2min |
| 0.8��64 |
| 0.8��64+0.4��32+1.2��80 |
| 51.2 |
| 160 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
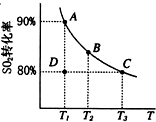
| ���� |
| ���¸�ѹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | �� | �� | �� | ||
| ��ʼ���ʵ��� | n��SO2��/mol | 0.40 | 0.40 | 0.80 | 0 |
| n��O2��/mol | 0.24 | 0.48 | 0.48 | 0.04 | |
| n��SO3��/mol | 0 | 0 | 0 | 0.40 | |
| ����Ӧ���ƽ��ת����/% | 80 | ��1 | ��2 | ��3 | |
| A������SO3��ƽ��ת����Ϊ��3=80% |
| B�����¶��£�ƽ�ⳣ����ֵΪ400 |
| C��ƽ��ʱ������c��SO3���Ǽ��е�2�� |
| D��ƽ��ʱ������O2��ת����С������O2��ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | x | 2.0 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2.0 | 1.0 | 0.40 | 1.6 | 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��150 mL 1 mol?L-1��KClO3 |
| B��75 mL 1.5 mol?L-1��NH4Cl |
| C��75 mL 2 mol?L-1��CaCl2 |
| D��150 mL 3 mol?L-1��KCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
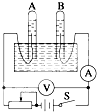 ��ͼ��ʾΪ���ˮ��װ�ã��պϿ���S�۲쵽��ѹ��ʾ��Ϊ6.0V��������ʾ��Ϊ100mA��
��ͼ��ʾΪ���ˮ��װ�ã��պϿ���S�۲쵽��ѹ��ʾ��Ϊ6.0V��������ʾ��Ϊ100mA���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com