
| A. | ③⑥ | B. | ①④ | C. | ②③⑥ | D. | ②④⑤ |
分析 ①由苯制取溴苯、硝基苯,发生取代反应,制备环己烷发生加成反应;
②碱性锌锰电池属于一次电池;
③碳素钢、不锈钢和目前流通的硬币都由不同的金属或金属与非金属熔合而成;
④浓盐酸不属于氧化性酸;
⑤氨水属于混合物;
⑥豆浆、淀粉水溶液、雾的粒子直径都介于1-100nm之间.
解答 解:①由苯制取溴苯、硝基苯,发生取代反应,制备环己烷发生加成反应,反应类型不同,故错误;
②碱性锌锰电池属于一次电池,故错误;
③碳素钢、不锈钢和目前流通的硬币都由不同的金属或金属与非金属熔合而成,都属于合金,故正确;
④浓盐酸为非氧化性酸,不具有强氧化性,故错误;
⑤氨水属于混合物,不是电解质,故错误;
⑥豆浆、淀粉水溶液、雾的粒子直径都介于1-100nm之间,属于胶体,故正确.
故选A.
点评 本题综合考查物质的分类,侧重考查学生的分析能力和双基的掌握,主要把握有机反应类型、物质的分类、合金以及原电池的工作原理等知识,难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
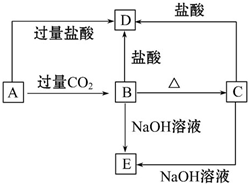 A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,已知A中含钾元素.
A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,已知A中含钾元素.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度要比水大 | |
| B. | 进行蒸馏操作时,应使温度计的水银球靠近蒸馏烧瓶的瓶口处 | |
| C. | 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 进行蒸发操作时,应将蒸发皿中溶液蒸干后,再停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 等量的Zn分别与足量的稀硫酸和浓硫酸反应所得气体体积相同 | |
| C. | Li、Na、K的原子半价和熔沸点随原子序数的增加而增大 | |
| D. | P、C、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com