
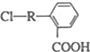
 (其中R为饱和烃基),X在一定条件下如图所示的转化关系,已知Q的蒸气密度是相同条件下H2密度的74倍,分子组成符号CaHbO2
(其中R为饱和烃基),X在一定条件下如图所示的转化关系,已知Q的蒸气密度是相同条件下H2密度的74倍,分子组成符号CaHbO2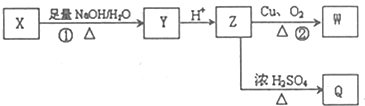
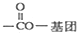 ),写出任意一种能发生银镜反应的符合上述条件的物质的结构简式
),写出任意一种能发生银镜反应的符合上述条件的物质的结构简式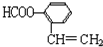
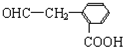 .于由X通过一步反应得到P,该反应的化学方程式是
.于由X通过一步反应得到P,该反应的化学方程式是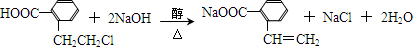
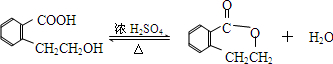 .
. 分析 Q的蒸气密度是相同条件下H2密度的74倍,则Mr(Q)=148,分子组成符合CaHbO2,则$\frac{148-32}{12}$=9…8,故Q分子式为C9H8O2,Q不饱和度为$\frac{2×9+2-8}{2}$=5,X的结构简式是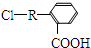 ,发生卤代烃水解反应、中和反应得到Y,Y酸化得到Z,则Z中含有-OH、-COOH,若Q能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成P,W能发生银镜反应,则Z发生消去反应生成Q,可推知Q为
,发生卤代烃水解反应、中和反应得到Y,Y酸化得到Z,则Z中含有-OH、-COOH,若Q能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成P,W能发生银镜反应,则Z发生消去反应生成Q,可推知Q为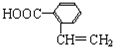 ,Z为
,Z为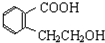 ,X为
,X为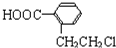 ,Y为
,Y为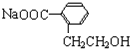 ,Z发生催化氧化生成W为
,Z发生催化氧化生成W为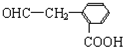 ,若Q中除苯环外,还含有一个六元环,则Q为
,若Q中除苯环外,还含有一个六元环,则Q为 ,据此解答.
,据此解答.
解答 解:Q的蒸气密度是相同条件下H2密度的74倍,则Mr(Q)=148,分子组成符合CaHbO2,则$\frac{148-32}{12}$=9…8,故Q分子式为C9H8O2,Q不饱和度为$\frac{2×9+2-8}{2}$=5,X的结构简式是 ,发生卤代烃水解反应、中和反应得到Y,Y酸化得到Z,则Z中含有-OH、-COOH,若Q能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成P,W能发生银镜反应,则Z发生消去反应生成Q,可推知Q为
,发生卤代烃水解反应、中和反应得到Y,Y酸化得到Z,则Z中含有-OH、-COOH,若Q能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成P,W能发生银镜反应,则Z发生消去反应生成Q,可推知Q为 ,Z为
,Z为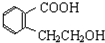 ,X为
,X为 ,Y为
,Y为 ,Z发生催化氧化生成W为
,Z发生催化氧化生成W为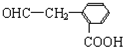 ,若Q中除苯环外,还含有一个六元环,则Q为
,若Q中除苯环外,还含有一个六元环,则Q为 .
.
(1)由上述分析可知,Q的分子式是C9H8O2,X为 ,共有羧基、氯原子,
,共有羧基、氯原子,
故答案为:C9H8O2;羧基、氯原子;
(2)符合下列要求的Q( )的同分异构体:①分子中苯环上有两个取代基,且分子结构中除苯环外不含其它环状结构,②该有机物含有
)的同分异构体:①分子中苯环上有两个取代基,且分子结构中除苯环外不含其它环状结构,②该有机物含有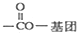 ,为羧基或酯基,侧链为-COOH、-CH=CH2,有邻、间、对3种,侧链为-OOCH、-CH=CH2,有邻、间、对3种,共有6种,任意一种能发生银镜反应的符合上述条件的物质的结构简式为:
,为羧基或酯基,侧链为-COOH、-CH=CH2,有邻、间、对3种,侧链为-OOCH、-CH=CH2,有邻、间、对3种,共有6种,任意一种能发生银镜反应的符合上述条件的物质的结构简式为: ,
,
故答案为:6; ;
;
(3)①若Q能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成P,W能发生银镜反应,则Z发生消去反应生成Q,可推知Q为 ,P为
,P为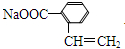 ,W为
,W为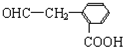 ,于由X通过一步反应得到P,该反应的化学方程式是:
,于由X通过一步反应得到P,该反应的化学方程式是: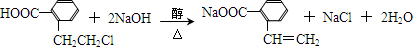 ,
,
故答案为: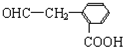 ;
;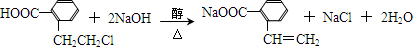 ;
;
②若Q中除苯环外,还含有一个六元环,则Q为 ,则Z→Q的化学方程式是:
,则Z→Q的化学方程式是: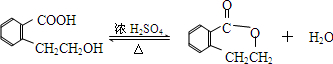 ,
,
故答案为: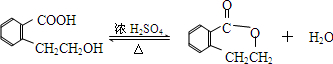 .
.
点评 本题考查有机物的推断,关键是确定Q的分子式,注意转化中碳链骨架不变,需要学生熟练掌握官能团的性质与转化,较好的考查学生分析推理能力,难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 充电时阴极发生氧化反应 | |
| B. | 放电时负极的电极反应为CH3OH+8OH--6e-═CO32-+6H2O | |
| C. | 通入0.25mol氧气并完全反应后,有1mol电子转移 | |
| D. | 放电时阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铁溶液中滴加HI溶液:2Fe3++2HI═2Fe2++2H++I2 | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(0H)2恰好使反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4+AlO2-+2H2O | |
| C. | 1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合2AlO2-+5H+═Al(OH)3+Al3++H2O | |
| D. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的烃有三种可能的结构 | |
| B. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| C. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| D. | 淀粉、纤维素和蛋白质都是高分子化合物,它们在一定条件下都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应停止了 | B. | 正反应速率与逆反应速率相等 | ||
| C. | 反应物和生成物浓度相等 | D. | 正反应速率与逆反应速率均为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池放电时,负极上发生反应的物质是Ag2O | |
| B. | 电池放电时,正极发生氧化反应 | |
| C. | 电池充电时,阳极上发生反应的物质是Ag | |
| D. | 电池充电时,阴极上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入品红溶液或者溴水都能使它们褪色,均说明SO2具有漂白性 | |
| B. | 蘸有浓氨水和蘸有浓HNO3的玻璃棒靠近时有白烟产生,是因为氨气有还原性 | |
| C. | 某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明溶液中一定没有NH4+ | |
| D. | NH3•H2O的热不稳定性可以解释实验室中用加热氨水的办法制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
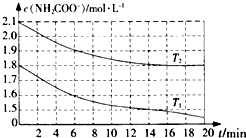 科学研究小组对氨基甲酸铵(NH2COONH4)的分解和水解反应进行探究.
科学研究小组对氨基甲酸铵(NH2COONH4)的分解和水解反应进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com