
【题目】反应①![]()
![]()
②![]()
![]()
在不同温度时![]() 、
、![]() 的值如表:
的值如表:
温度 |
|
|
973 |
|
|
1173 |
|
|
据此可知反应③:“![]()
![]() ”的相关信息正确的是( )
”的相关信息正确的是( )
A.![]()
B.该反应正反应为吸热反应
C.该反应进行时不断分离出![]() ,可以提高
,可以提高![]() 的转化率和反应速率
的转化率和反应速率
D.在恒温且容积可变的容器中发生反应③,压缩体积反应速率会增大,![]() 也增大
也增大
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
A. x=4 B. 2 min内B的反应速率为0.1 mol·(L·min)-1
C. 混合气体密度不变,则表明该反应已达到平衡状态 D. B的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒氧化还原液流电池是一种新型绿色的二次电池。其工作原理如图所示。下列叙述正确的是

A.放电时,电子由Y极流出,经质子交换膜到X极
B.放电过程中,电解质溶液pH降低
C.充电时,X极反应式为:VO2++H2O -e- = VO2++2H+
D.放电时,每转移1 mol电子理论上有2 mol H+由交换膜右侧向左侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
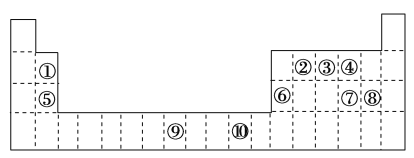
(1)表中位于ds区的元素是________(填编号),写出该元素基态原子的电子排布式:___________。
(2)①和⑧形成的化合物分子中,中心原子的杂化轨道类型为________,⑥和⑧形成的化合物的晶体类型是________。
(3)②、③、④三种元素中,第一电离能最大的是________(填编号)。
(4)元素③的简单气态氢化物在水中的溶解度比同族其他元素的氢化物大很多的原因是____________________________________________________________________________________。
(5)⑤与④形成的晶体的熔点高于⑤与⑦形成的晶体的熔点,原因____________________________。
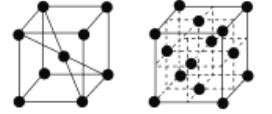
(6)1183K以下,元素⑨的单质为体心立方晶体(晶胞结构如图1),1183K以上转变为面心立方晶体(晶胞结构如图2)。在图2中,与一个原子距离最近且相等的原子个数为________,图1与图2所示晶胞中含有的原子个数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于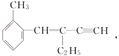 ,下列结论正确的是( )
,下列结论正确的是( )
A. 该有机物分子式为C13H16 B. 该有机物属于苯的同系物
C. 该有机物分子至少有4个碳原子共直线 D. 该有机物分子最多有13个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10
②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如图1所示:


(1)下列有关氢氟酸性质中可以证明它是弱电解质的是________________
A. 常温下0.1mol/L的氢氟酸溶液pH约为2
B. 氢氟酸溶液能使紫色石蕊溶液变红
C. 10mL 1mol/L 氢氟酸恰好与10mL 1mol/L NaOH溶液完全反应
D. 某氢氟酸溶液与金属镁反应的速率比较慢
E. 相同条件下氢氟酸溶液的导电能力比盐酸的弱
(2)NaF是一种农业杀虫剂,溶液中四种离子浓度大小关系为___________________
(3)25℃时,将20mL 0.10 mol/L CH3COOH溶液和20mL 0.10 mol/LHSCN溶液分别与20mL 0.10 mol/LNaHCO3溶液混合,分别得到溶液1和溶液2,实验测产生的气体体积(V)随时间(t)变化如图2所示,曲线a反映的是________________(填“CH3COOH”或“HSCN”)与NaHCO3反映产生气体的变化情况,反应结束后所得两溶液中,c(OH-)溶液1_______c(OH-)溶液2 (填“>”、“<”或“=”)
(4)CaF2俗名萤石,难溶于水,若将4.0×10-3mol/L HF溶液与2.0×10-4mol/L CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),判断此时溶液中是否有CaF2沉淀生成并说明理由______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)![]() 2Z(g) 一定达到化学平衡状态的是( )
2Z(g) 一定达到化学平衡状态的是( )
①容器中气体的密度不再发生变化 ② X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a-Fe(III)晶面铁原子簇是合成氨工业的一种新型高效催化剂,N2和H2在其表面首先变为活化分子,反应机理为①H2 (g)=2H(g) △H1,②N2(g)+2H(g)2(NH)(g) △H2, ③(NH)(g)+H(g)![]() (NH2)(g) △H3, ④(NH2)(g)+H(g)
(NH2)(g) △H3, ④(NH2)(g)+H(g) ![]() NH3 (g) △H4,总反应为N2 (g)+3H2(g)
NH3 (g) △H4,总反应为N2 (g)+3H2(g)![]() 2NH3 (g) △H。下列说法正确的是
2NH3 (g) △H。下列说法正确的是
A. 催化剂能够有效降低反应的活化能和改变反应的焓变
B. 增大压强和使用高效催化剂均有利于提高总反应的平衡转化率
C. 反应①和总反应均为放热反应
D. △H=3△H1+△H2+2△H3+2△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )(A→F从△H1递增到△H6)
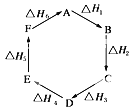
A. A→F △H=-△H6 B. △H1+△H2+△H3+△H4+△H5+△H6=1
C. C→F ∣△H∣=∣△H1+△H2+△H6∣ D. ∣△H1+△H2+△H3∣=∣△H4+△H5+△H6∣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com