
| A. | 与H2化合能力:At2>I2 | B. | 砹在常温下为白色固体 | ||
| C. | 砹原子的最外电子层上有7个电子 | D. | 砹能从NaCl溶液中置换出氯单质 |
分析 A.非金属元素的非金属性越强,与氢气化合越容易;
B.卤素单质均有颜色;
C.第VIIA元素原子最外层含有7个电子;
D.氧化性强的单质能把氧化性弱的从溶液中置换出来.
解答 解:A.非金属元素的非金属性越强,与氢气化合越容易,At的非金属性较弱,所以与H2化合能力:I2>At2,故A错误;
B.卤素单质均有颜色,所以砹不可能为白色,故B错误;
C.第VIIA元素原子最外层含有7个电子,则砹原子的最外电子层上有7个电子,故C正确;
D.氧化性强的单质能把氧化性弱的从溶液中置换出来,氯气的氧化性大于砹,所以砹不能从NaCl溶液中置换出氯单质,故D错误;
故选C.
点评 本题考查同一主族元素性质递变规律,侧重考查学生知识迁移能力,以氯元素为例采用知识迁移的方法分析解答即可,注意同一主族元素、同一周期元素性质递变规律,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
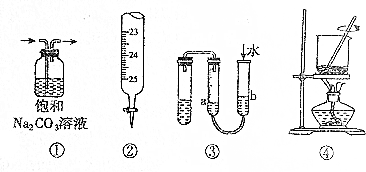
| A. | ①用于除去CO2中的SO2 | B. | ②用于量取20.00mL Na0H溶液 | ||
| C. | ③用于判断装置的气密性 | D. | ④用于将海带燃烧成灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | w.9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | w0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
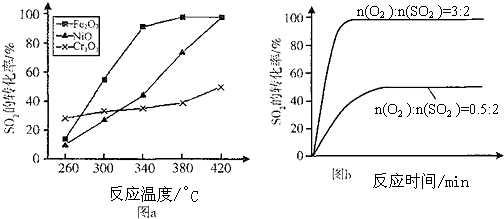
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1 083 | 660 | 1 535 |
| 沸点/℃ | 883 | 2 595 | 2 200 | 3 000 |
| A. | Cu与Na | B. | Fe与Cu | C. | Fe与Al | D. | Al与Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KHCO3和MgCO3 | B. | K2CO3和Na2CO3 | C. | MgCO3和Na2CO3 | D. | KHCO3和NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com