
ŅŃÖŖij·“Ó¦ĪŖ£ŗ
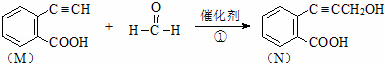
£Ø1£©1molMĶźČ«Č¼ÉÕŠčŅŖ””9.5””molO2£®£®
£Ø2£©ÓŠ»śĪļN²»æÉ·¢ÉśµÄ·“Ó¦ĪŖ””C””£ŗ
A£®Ńõ»Æ·“Ó¦”” B£®Č”“ś·“Ó¦”” C£®ĻūČ„·“Ó¦
D£®»¹Ō·“Ó¦ E£®¼Ó³É·“Ó¦
£Ø3£©MÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬ĘäÖŠÄÜŹ¹FeCl3ČÜŅŗĻŌ×ĻÉ«”¢±½»·ÉĻÖ»ÓŠĮ½øöČ”“ś»ł”¢ĪŽ»·ĪļÖŹµÄĶ¬·ÖŅģ¹¹ĢåÓŠ””6””ÖÖ£®
£Ø4£©ĪļÖŹNÓėH2·“Ӧɜ³ÉµÄP£Ø½į¹¹¼ņŹ½ĪŖ£©·¢ÉśĖõ¾Ū·“Ó¦²śĪļµÄ½į¹¹¼ņŹ½ĪŖ””””£»PĪļÖŹµÄÄĘŃĪŌŚŹŹµ±Ģõ¼žĻĀŃõ»ÆĪŖ·¼ĻćČ©Q£¬ŌņQÓėŅų°±ČÜŅŗ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ””””£®
£Ø5£©ÓŠ»śĪļ¢ń”¢¢ņ”¢¢óµÄ×Ŗ»Æ¹ŲĻµĪŖ£ŗ¢ń ¢ņ
¢ņ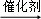 ¢ó
¢ó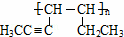
ÓŠ»śĪļ¢ņµÄ½į¹¹¼ņŹ½ĪŖ””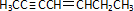 ””£»A”¢BæÉŅŌ·¢ÉśĄąĖĘ¢ŁµÄ·“Ӧɜ³ÉÓŠ»śĪļ¢ń£¬ŌņøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ””
””£»A”¢BæÉŅŌ·¢ÉśĄąĖĘ¢ŁµÄ·“Ӧɜ³ÉÓŠ»śĪļ¢ń£¬ŌņøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ””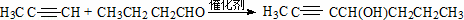 ””£®
””£®
| ÓŠ»śĪļµÄĶʶĻ£»ÓŠ»śĪļµÄ½į¹¹ŗĶŠŌÖŹ£®. | |
| ·ÖĪö£ŗ | £Ø1£©ŹéŠ“MµÄ·Ö×ÓŹ½£¬ŅĄ¾ŻCxHyOŗÄŃõĮæ=x+©¼ĘĖć£» £Ø2£©ÓŠ»śĪļNÖŠŗ¬ÓŠĢ¼Ģ¼Čż¼ü”¢±½»·”¢“¼ōĒ»ł”¢ōČ»ł£¬½įŗĻŌ×ÓĶŵÄĢŲÕ÷ŠŌÖŹ·ÖĪöÅŠ¶Ļ·¢ÉśµÄ»Æѧ·“Ó¦ĄąŠĶ£» £Ø3£©MÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬ĘäÖŠÄÜŹ¹FeCl3ČÜŅŗĻŌ×ĻÉ«£¬ĖµĆ÷ŗ¬ÓŠ·ÓōĒ»ł£¬±½»·ÉĻÖ»ÓŠĮ½øöČ”“ś»ł”¢ĪŽ»·ĪļÖŹ£¬ĮķŅ»øöČ”“ś»łĪŖ©£ØCO£©©C”ŌCH£¬ĮŚ¼ä¶ŌČżÖÖĶ¬·ÖŅģ¹¹Ģ壬Ņ²æÉŅŌŹĒ©C”ŌC©CHO£¬Ņ²“ęŌŚĮŚ¼ä¶ŌČżÖÖĶ¬·ÖŅģ¹¹Ģ壻 £Ø4£©ōČ»łŗĶ“¼ōĒ»łÖ®¼ä·¢ÉśĖõ¾Ū·“Ó¦£¬Ķعżõ„»Æ·“Ó¦ĖõČ„Ė®ŠĪ³Éøß·Ö×Ó»ÆŗĻĪļ£¬£» £Ø5£©PĪļÖŹµÄÄĘŃĪŌŚŹŹµ±Ģõ¼žĻĀŃõ»ÆĪŖ·¼ĻćČ©QŗĶŅų°±ČÜŅŗ·¢ÉśŃõ»Æ·“Ó¦£¬³öĻÖŅų¾µĻÖĻó£¬ŅĄ¾ŻČ©»ł±»Ńõ»ÆµÄ·“Ó¦ŌĄķŹéŠ“»Æѧ·½³ĢŹ½£» £Ø5£©ÓŠ»śĪļ¢ņŹĒ¼Ó³É¾ŪŗĻĪļµÄµ„Ģå£¬Č„µōÖŠĄØŗŵ„¼ü±äĖ«¼üµĆµ½£¬A”¢BæÉŅŌ·¢ÉśĄąĖĘ¢ŁµÄ·“Ӧɜ³ÉÓŠ»śĪļ¢ń£¬ŅĄ¾ŻÓŠ»śĪļ¢ņŹĒÓŠ»śĪļ¢ńŹ§Ė®µĆµ½£¬ĖłŅŌÓŠ»śĪļ¢ņÖŠµÄĢ¼Ģ¼Ė«¼üŹĒ“¼ōĒ»łĻūČ„Ė®·“Ӧɜ³É£¬Ņņ“ĖÓŠ»śĪļ¢ńŹĒ±ūČ²ŗĶÕż¶”“¼·¢Éś·“Ӧɜ³É£» |
| ½ā“š£ŗ | ½ā£ŗ£Ø1£©ŹéŠ“MµÄ·Ö×ÓŹ½ĪŖC9H6O2£¬ŅĄ¾ŻCxHyOŗÄŃõĮæ=x+©¼ĘĖć£¬1molMŗÄŃõĮæ=9+©=9.5mol£¬ ¹Ź“š°øĪŖ£ŗ9.5£» £Ø2£©ÓŠ»śĪļNÖŠŗ¬ÓŠĢ¼Ģ¼Čż¼ü”¢±½»·”¢“¼ōĒ»ł”¢ōČ»ł£¬½įŗĻŌ×ÓĶŵÄĢŲÕ÷ŠŌÖŹ·ÖĪöÅŠ¶Ļ·¢ÉśµÄ»Æѧ·“Ó¦ĄąŠĶ A£®Ģ¼Ģ¼Čż¼ü”¢“¼ōĒ»łæÉŅŌ·¢ÉśŃõ»Æ·“Ó¦£¬¹ŹA²»·ūŗĻ£»”” B£®“¼ōĒ»ł”¢±½»·ÉĻµÄĒāŌ×ÓæÉŅŌ·¢ÉśČ”“ś·“Ó¦£¬¹ŹB²»·ūŗĻ£»”” C£®“¼ōĒ»łĻąĮŚĢ¼Ō×ÓÉĻĪŽĒāŌ×Ó²»ÄÜ·¢ÉśĻūČ„·“Ó¦£¬¹ŹC·ūŗĻ£» D£®Ģ¼Ģ¼Čż¼ü”¢±½»·æÉŅŌŗĶĒāĘų·¢Éś¼Ó³É·“Ó¦ŹōÓŚ»¹Ō·“Ó¦£¬¹ŹD²»·ūŗĻ£» E£®Ģ¼Ģ¼Čż¼ü”¢±½»·æÉŅŌŗĶĒāĘų·¢Éś¼Ó³É·“Ó¦£¬¹ŹE²»·ūŗĻ£» ¹Ź“š°øĪŖ£ŗC£» £Ø3£©MÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬ĘäÖŠÄÜŹ¹FeCl3ČÜŅŗĻŌ×ĻÉ«£¬ĖµĆ÷ŗ¬ÓŠ·ÓōĒ»ł£¬±½»·ÉĻÖ»ÓŠĮ½øöČ”“ś»ł”¢ĪŽ»·ĪļÖŹ£¬ĮķŅ»øöČ”“ś»łĪŖ©£ØCO£©©C”ŌCH£¬ĮŚ¼ä¶ŌČżÖÖĶ¬·ÖŅģ¹¹Ģ壬Ņ²æÉŅŌŹĒ©C”ŌC©CHO£¬Ņ²“ęŌŚĮŚ¼ä¶ŌČżÖÖĶ¬·ÖŅģ¹¹Ģ壬Ķ¬·ÖŅģ¹¹ĢåÓŠ6ÖÖ£¬ ¹Ź“š°øĪŖ£ŗ6£» £Ø4£©ōČ»łŗĶ“¼ōĒ»łÖ®¼ä·¢ÉśĖõ¾Ū·“Ó¦£¬Ķعżõ„»Æ·“Ó¦ĖõČ„Ė®ŠĪ³Éøß·Ö×Ó»ÆŗĻĪļ£¬ PĪļÖŹ ¹Ź“š°øĪŖ£ŗ
£Ø5£©ÓŠ»śĪļ¢ņŹĒ¼Ó³É¾ŪŗĻĪļµÄµ„Ģå£¬Č„µōÖŠĄØŗŵ„¼ü±äĖ«¼üµĆµ½½į¹¹¼ņŹ½ĪŖ£ŗ ¹Ź“š°øĪŖ£ŗ |
| µćĘĄ£ŗ | ±¾Ģāæ¼²éĮĖÓŠ»śĪļŠŌÖŹ”¢¹ŁÄÜĶŽį¹¹£¬»Æѧ·“Ó¦ĄąŠĶµÄ·ÖĪöÅŠ¶Ļ£¬×¢Ņāøß¾ŪĪļŠĪ³ÉµÄ·“Ó¦ŹµÖŹ£¬ÕĘĪÕ»ł“”ŹĒ¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£® |
””


 Ö„ĀéæŖ»ØæĪ³ĢŠĀĢåŃéĻµĮŠ“š°ø
Ö„ĀéæŖ»ØæĪ³ĢŠĀĢåŃéĻµĮŠ“š°ø ŌõѳѧŗĆÅ£½ņÓ¢ÓļĻµĮŠ“š°ø
ŌõѳѧŗĆÅ£½ņÓ¢ÓļĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĮņĖįŌüŹĒÓĆ»ĘĢśæóÖĘŌģĮņĖį¹ż³ĢÖŠÅųöµÄ·ĻŌü£¬Ö÷ŅŖ»Æѧ³É·ÖĪŖSiO2(Ō¼45%)”¢Fe2O3(Ō¼40%)”¢Al2O3(Ō¼10%)ŗĶMgO(Ō¼5%)”£Ä³Ķ¬Ń§Éč¼ĘĮĖČēĻĀ·½°ø£¬·ÖĄėѳʷ֊ø÷ÖÖ½šŹōŌŖĖŲ”£Ēė»Ų“šĻĀĮŠĪŹĢā”£
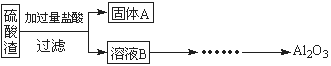
£Ø1£©Š“³öČÜŅŗBµÄČÜÖŹŹĒ ”£
£Ø2£©²ĪÕÕŅŌĻĀæņĶ¼ŠĪŹ½½ųŅ»²½Ķź³É”°ČÜŅŗC”±µ½”°Al2O3”±µÄĮ÷³Ģ£Ø×¢Ć÷ŹŌ¼Į”¢Ģõ¼žŗĶ²Ł×÷£© ”£

£Ø3£©ĪŖĮĖ·ÖĪöijĮņĖįŌüÖŠĢśŌŖĖŲµÄŗ¬Į棬ĻČ½«ĮņĖįŌüŌ¤“¦Ąķ£¬°ŃĢśŌŖĖŲ»¹Ō³ÉFe2+£¬ŌŁÓĆKMnO4±ź×¼ČÜŅŗŌŚĖįŠŌĢõ¼žĻĀ½ųŠŠŃõ»Æ»¹ŌµĪ¶Ø”£Š“³ö·“Ó¦µÄĄė·½³ĢŹ½£ŗ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠŗĻ³Éøß·Ö×Ó»ÆŗĻĪļµÄ·“Ó¦¼°ĄąŠĶ¾łÕżČ·µÄŹĒ(””””)
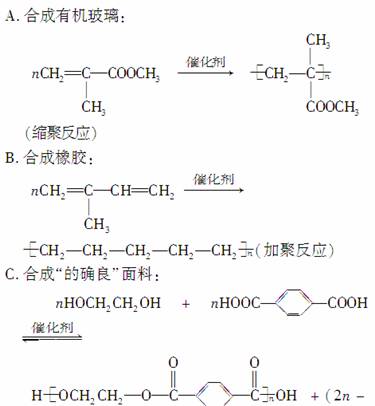 £1)H2O
£1)H2O
(Ėõ¾Ū·“Ó¦)
D£®ŗĻ³ÉHTĻĖĪ¬£ŗ
 (Ėõ¾Ū·“Ó¦)
(Ėõ¾Ū·“Ó¦)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Čż¾ŪĒč°·£Ø»ÆѧŹ½£ŗC3N6H6£©ŹĒŅ»ÖÖÖŲŅŖÓŠ»ś»Æ¹¤ŌĮĻ”£ĻĀĶ¼ŹĒĪŅ¹śæĘ¼¼¹¤×÷ÕßŃŠÖʵÄŅŌÄņĖŲĪŖŌĮĻÉś²śČż¾ŪĒč°·µÄ¹¤ŅÕ”Ŗ”Ŗ”°³£Ń¹ĘųĻąŅ»²½·ØĮŖ²ś“æ¼īŠĀ¼¼Źõ”±£ŗ
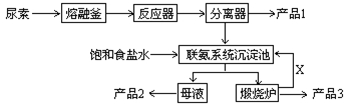
ŅŃÖŖ£ŗŅŌÄņĖŲĪŖŌĮĻÉś²śČż¾ŪĒč°·µÄŌĄķŹĒ£ŗ6 CO(NH2)2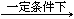 C3N6H6 +6 NH3+3CO2
C3N6H6 +6 NH3+3CO2
Ēė»Ų“š£ŗ
£Ø1£©ÄņĖŲµÄ½į¹¹Ź½ĪŖ
£Ø2£©ŅŃÖŖ£ŗ²śĘ·1ŹĒ±¾¹¤ŅÕµÄÖ÷²śĘ·£¬²śĘ·2ŹĒø±²śĘ·£¬XĪŖŃ»·Ź¹ÓƵÄĪļÖŹ£¬²śĘ·3ĪŖ“æ
¼ī”£Š“³öø÷Ö÷ŅŖ³É·ŻµÄ»ÆѧŹ½£ŗ²śĘ·1 ²śĘ·2 X
£Ø3£©ĮŖ°±ĻµĶ³³Įµķ³ŲÖŠ·¢ÉśµÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ£ŗ
£Ø4£©ĪŖĮĖŹ¹ÄøŅŗÖŠĪö³öøü¶ąµÄ²śĘ·2 £¬³£ÓƵķ½·ØŹĒ
A”¢¼ÓČė¹ĢĢåNaCl B”¢¼ÓČė¹ĢĢåNaHCO3 C”¢ĶØČėCO2ĘųĢå D”¢ĶØČėNH3
£Ø5£©ČōÉś²ś¹ż³ĢÖŠÓŠ4%µÄÄņĖŲĖšŗÄ£¬Ćæ¶ÖÄņĖŲĄķĀŪÉĻæɵĆø±²śĘ·“æ¼ī ¶Ö£Ø¾«Č·µ½0£®001£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÉčNA“ś±ķ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©
| ”” | A£® | 1.00 mol•L©1 NaClČÜŅŗÖŠŗ¬ÓŠNa+µÄŹżÄæĪŖNA |
| ”” | B£® | ³£ĪĀ³£Ń¹ĻĀ£¬6.4 gÓÉŃõĘųŗĶ³ōŃõ×é³ÉµÄ»ģŗĻĪļÖŠŗ¬ÓŠµÄ·Ö×Ó×ÜŹżĪŖ0.2NA |
| ”” | C£® | ±ź×¼×“æöĻĀ£¬1.12 L HCHOÖŠCŌ×ӵďżÄæĪŖ0.05 NA |
| ”” | D£® | ŌŚ“߻ƼĮ×÷ÓĆĻĀ£¬6.4g SO2Óė×ćĮæŃõĘų·“Ӧɜ³ÉSO3£¬×ŖŅʵē×ÓŹżĪŖ0.2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
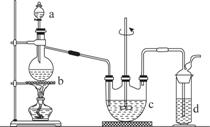
Įņ“śĮņĖįÄĘ(Na2S2O3)æÉÓĆ×ö·ÖĪöŹŌ¼Į¼°÷·øļ»¹Ō¼Į”£ĖüŅ×ČÜÓŚĖ®£¬²»ČÜÓŚ“¼£¬ŹÜČČ”¢ÓöĖįŅ×·Ö½ā”£¹¤ŅµÉĻæÉÓĆ·“Ó¦£ŗ2Na2S£«Na2CO3£«4SO2===3Na2S2O3£«CO2ÖʵƔ£ŹµŃéŹŅÄ£ÄāøĆ¹¤Ņµ¹ż³ĢµÄ×°ÖĆČēĶ¼ĖłŹ¾”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)bÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ________________£¬cÖŠŹŌ¼ĮĪŖ________”£
(2)·“Ó¦æŖŹ¼ŗó£¬cÖŠĻČÓŠ»ė×Ē²śÉś£¬ŗóÓÖ±ä³ĪĒ唣“Ė»ė×ĒĪļŹĒ________”£
(3)dÖŠµÄŹŌ¼ĮĪŖ________”£
(4)ŹµŃéÖŠŅŖæŲÖĘSO2Éś³ÉĖŁĀŹ£¬æÉŅŌ²ÉČ”µÄ“ėŹ©ÓŠ___________________________________(Š“³öĮ½Ģõ)”£
(5)ĪŖĮĖ±£Ö¤Įņ“śĮņĖįÄĘµÄ²śĮ棬ŹµŃéÖŠĶØČėµÄSO2²»ÄܹżĮ棬ŌŅņŹĒ______________________”£
(6) ĖłµĆ²śĘ·³£ŗ¬ÓŠÉŁĮæNa2SO3ŗĶNa2SO4”£ĪŖŃéÖ¤²śĘ·ÖŠŗ¬ÓŠNa2SO3ŗĶNa2SO4£¬øĆŠ”×éÉč¼ĘĮĖŅŌĻĀŹµŃé·½°ø£¬Ēė½«·½°ø²¹³äĶźÕū”£(ĖłŠčŹŌ¼Į“ÓĻ”HNO3”¢Ļ”H2SO4”¢Ļ”ŃĪĖį”¢ÕōĮóĖ®ÖŠŃ”Ōń)
¢ŁČ”ŹŹĮæ²śĘ·Åä³ÉĻ”ČÜŅŗ£¬µĪ¼Ó×ćĮæBaCl2ČÜŅŗ£¬ÓŠ°×É«³ĮµķÉś³É£¬________________£¬Čō³ĮµķĪ“ĶźČ«Čܽā£¬²¢ÓŠ“Ģ¼¤ŠŌĘųĪ¶µÄĘųĢå²śÉś£¬ŌņæÉČ·¶Ø²śĘ·ÖŠŗ¬ÓŠNa2SO3ŗĶNa2SO4”£
¢ŚĪŖ¼õɣװÖĆCÖŠÉś³ÉNa2SO4µÄĮ棬ŌŚŹµŃé¹ż³Ģ֊ӦעŅāµÄ²Ł×÷Ė³ŠņŹĒ_______________________________________________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖXŗĶYŹĒĮ½ÖÖµ„ÖŹ£¬X+Y”śX2++Y2- £¬ĻÖÓŠĻĀĮŠŠšŹöÕżČ·µÄŹĒ£ŗ ¢ŁX±»Ńõ»Æ ¢ŚXŹĒŃõ»Æ¼Į ¢ŪY2-ŹĒ»¹Ō²śĪļ ¢ÜX2+¾ßÓŠŃõ»ÆŠŌ ¢ŻY2-¾ßÓŠ»¹ŌŠŌ ¢ŽYµ„ÖŹŃõ»ÆŠŌ±ČX2+Ńõ»ÆŠŌĒæ
A£®¢Ł¢Ś¢Ū B£®¢Ł¢Ś¢Ž C£®¢Ł¢Ū¢Ü¢Ż¢Ž D£®¢Ł¢Ū¢Ü¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŗĖĢĒŹĒŗĻ³ÉŗĖĖįµÄÖŲŅŖŌĮĻ£¬½į¹¹¼ņŹ½ĪŖCH2OH—CHOH—CHOH—CHOH—CHO£¬ĻĀĮŠ¹ŲÓŚŗĖĢĒµÄ
ŠšŹöÕżČ·µÄŹĒ (””””)
A£®ÓėĘĻĢŃĢĒ»„ĪŖĶ¬·ÖŅģ¹¹Ģå
B£®æÉÓėŠĀÖʵÄCu(OH)2Šü×ĒŅŗ×÷ÓĆÉś³ÉשŗģÉ«³Įµķ
C£®²»ÄÜ·¢ÉśČ”“ś·“Ó¦
D£®æÉŅŌŹ¹×ĻÉ«µÄŹÆČļŹŌŅŗ±äŗģ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
»„ĪŖĶ¬·ÖŅģ¹¹ĢåµÄĪļÖŹ²»æÉÄÜ(””””)
A£®¾ßÓŠĻąĶ¬µÄĻą¶Ō·Ö×ÓÖŹĮæ
B£®¾ßÓŠĻąĶ¬µÄ·Ö×ÓŹ½
C£®¾ßÓŠĻąĶ¬µÄ×é³ÉŌŖĖŲ
D£®¾ßÓŠĻąĶ¬µÄČŪ”¢·Šµć
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com