
【题目】下列有关说法正确的是( )
A.检验FeCl3溶液中是否含有Fe2+,可向溶液中加入酸性高锰酸钾溶液,观察溶液是否褪色
B.己知:2CH2=CH2+O2![]() 2
2 ![]() ,该反应的反应类型为氧化反应
,该反应的反应类型为氧化反应
C.己知Ksp(BaCO3)=2.58×10-9,Ksp(BaSO4)=1.1×10-10,所以碳酸钡的溶解度一定大于硫酸钡
D.用裂化汽油萃取溴水中的溴
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】某化学学习小组设计以下实验方案:测定某含有NaCl的小苏打样品中![]() 的质量分数。已知:
的质量分数。已知:![]() 受热分解成碳酸钠、二氧化碳和水。
受热分解成碳酸钠、二氧化碳和水。
(方案一)称取一定质量样品,置于仪器A中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)仪器A的名称为___________;A应该放在_________中冷却。恒重操作的目的是________。
(2)本实验从称量空的A仪器开始,完成一次平行实验至少需要称重____次。做平行实验的目的是___________。
(方案二)称取一定质量的样品(样品的质量为m0),置于小烧杯中,加适量水溶解;向小烧杯中加入足量澄清石灰水,过滤,洗涤、干燥,称量沉淀的质量为m1,计算。(已知碳酸钙式量为100,![]() 的式量为84)。
的式量为84)。
(3)反应方程式为_____________,则样品中![]() 的质量分数可以表示为_________。
的质量分数可以表示为_________。
(方案三)往Y形管中注入一定体积和浓度的稀硫酸并放入准确称取的ag样品,连接好注射器(如图),再将Y形管倾斜,使样品与酸液充分反应。
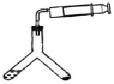
(4)a不能太大,理由是___________,若测定结果偏高,其原因可能是______(选填序号)。
①样品未完全反应
②温度未恒定即记录数据
③少量![]() 溶解在溶液中
溶解在溶液中
(方案四)称取一定质量样品,配成待测溶液,用标准盐酸滴定。
(5)下列叙述正确的是_______(选填序号)。
①用烧杯配制100mL待测溶液
②用酚酞为指示剂
③当滴至待测液变色并能将该颜色保持半分钟即为滴定终点
④盛盐酸的滴定管未润洗会造成实验结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙在工农业生产中有广泛的用途。
Ⅰ.过氧化钙制备方法很多。
(1)制备方法一:H2O2溶液与过量的Ca(OH)2悬浊液反应可制备CaO2·8H2O,其化学方程式为______________________________________________________________。
(2)制备方法二:利用反应Ca(s)+O2![]() CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
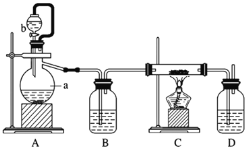
请回答下列问题:
①装置A中反应的化学方程式为________________,仪器a的名称为 ___________。
②装置D中盛有的液体是浓硫酸,其作用一是_________;二是_____________。
Ⅱ.水产运输中常向水中加一定量CaO2·8H2O增加溶氧量(DO),水中溶氧量(DO)是用每升水中溶解氧气的质量来表示,其测定步骤及原理为:
a.固氧:碱性下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+4OH=2MnO(OH)2↓;
b.氧化:酸性下,MnO(OH)2将I氧化为I2:MnO(OH)2+2I+4H+=Mn2++I2+3H2O;
c.滴定:用Na2S2O3标准溶液滴定生成的I2:2S2O32-+I2=S4O62-+2I。
某同学向水中加一定量CaO2·8H2O,取此水样100.00mL,按上述方法测定水中溶氧量(DO),消耗0.0100mol·L1 Na2S2O3标准溶液13.50mL。
(1)滴定过程中使用的指示剂是_______________________________;
(2)该水样中的溶解氧量(DO)为__________________mg·L1。
(3)步骤b中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因________________________(用离子方程式表示,至少写出2个)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。AC2是非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子在外界。根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_________;
(2)B的氢化物的分子立体构型是_____;其中心原子采取_______杂化。
(3)写出化合物AC2的电子式为_______;一种由B、C组成的化合物与AC2互为等电子体,其化学式为______。
(4)E的核外电子排布式是______,ECl3形成的配合物的化学式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20 mL l mol/L的某二元弱酸H2X溶液中逐渐加入NaOH固体(忽略溶液温度及体积变化),测得溶液中的H2X、HX-、X2-的物质的量浓度与溶液pH变化关系如图。下列叙述错误的是( )
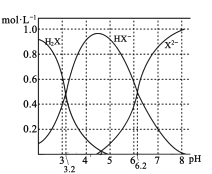
A.NaHX的水溶液呈酸性
B.当加入NaOH固体0.01 mol时,溶液pH= 3.2
C.当加入NaOH固体0.02 mol时,溶液中的离子浓度大小关系为:c(Na+)>c(HX-)>c(H+)>c(X2-)> c(OH-)
D.当加入NaOH固体0.04 mol时,溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(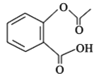 )是一种用途很广的消炎镇痛药物。可以通过以下方法合成:
)是一种用途很广的消炎镇痛药物。可以通过以下方法合成:

已知:
![]() +
+![]()
![]()
![]() +HCl
+HCl
3CH3COOH+PCl3→3CH3COCl+H3PO3
请回答下列问题:
(1)阿司匹林中的含氧官能团有____(写名称),反应①的化学反应类型为____。
(2)通过水杨酸还可制得香料E和高分子化合物G:
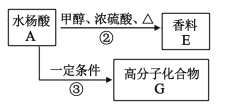
①请写出A→E的化学反应方程式____。
②已知G是一种聚酯,请写出其结构简式____。
(3)写出水杨酸所有属于芳香酯的同分异构体的结构简式____。
(4)结合题中信息,以苯酚、异丁烯为原料(其它无机原料自选)合成聚合物 的流程路线如下:
的流程路线如下:![]()
![]() ……→
……→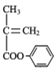 →
→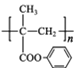 。请完善合成流程省略部分____。
。请完善合成流程省略部分____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.22.4L乙烯中C-H键数为4NA
B.1.5g甲基中电子数为1.0NA
C.标准状况下,22.4L苯中含有的碳原子数为6.0NA
D.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物是苯环上一个
的有机物是苯环上一个![]() 原子被取代后得到的物质,下列判断错误的是( )
原子被取代后得到的物质,下列判断错误的是( )
A.![]() 属于苯的同系物
属于苯的同系物
B.该有机物的结构有4种
C.该有机物的某种结构的核磁共振氢谱有4组峰
D.该有机物所有结构的一溴代物种类相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com