
| A. | 0.5mol | B. | 0.8mol | C. | 0.9mol | D. | 1.2mol |
分析 依据化学平衡的三段式列式计算,设起始量A的物质的量浓度为x,B的物质的量浓度为y,则得到:
A(g)+2B(g)?C(g)+2D(g)
起始量(mol/L) x y 0 0
变化量(mol/L) 0.15 0.3 0.15 0.3
平衡量(mol/L) 0.3 0.2 0.15 0.3
起始量=消耗量+平衡量,据此计算,注意计算过程中单位的应用;
解答 解:依据化学平衡的三段式列式计算,设起始量A的物质的量浓度为x,B的物质的量浓度为y,则得到:
A(g)+2B(g)?C(g)+2D(g)
起始量(mol/L) x y 0 0
变化量(mol/L) 0.15 0.3 0.15 0.3
平衡量(mol/L) 0.3 0.2 0.15 0.3
最初向容器里加入A的物质的量浓度x=0.3mol/L+0.15mol/L=0.45mol/L;
最初向容器里加入A的物质的量为0.45mol/L×2L=0.9mol;
故选C.
点评 本题考查了化学平衡的三段式计算应用,掌握基础是关键,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
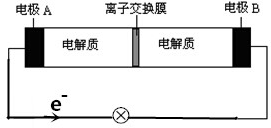
| A. | 放电时,Na+从右到左通过离子交换膜 | |
| B. | 放电时,负极反应式为3NaBr-2e-═NaBr3+2Na+ | |
| C. | 充电时,A极应与直流电源负极相连 | |
| D. | 放电时,当有0.1molNa+通过离子交换膜时,B极上有0.3molNaBr产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 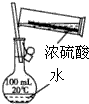 稀释浓硫酸 | |
| B. | 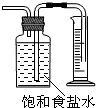 测量Cl2的体积 | |
| C. | 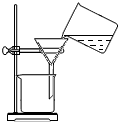 过滤 | |
| D. | 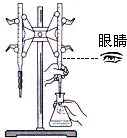 用NaOH标准溶液滴定锥形瓶中的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中含有共价键,故是共价化合物 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,但化学性质几乎相同 | |
| D. | Fe(OH)3胶体是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com