
| A、酸式盐的水溶液一定显酸性 |
| B、酸性氧化物一定是非金属氧化物 |
| C、丁达尔效应是溶液和胶体的本质区别 |
| D、HClO是弱酸,但NaClO是强电解质 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
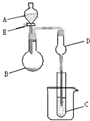 一个装置有多种用途是化学实验中经常出现的问题.用图所示装置进行实验,将A逐滴加入B中:
一个装置有多种用途是化学实验中经常出现的问题.用图所示装置进行实验,将A逐滴加入B中:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1 mol?L-1 NaHCO3溶液中:c(CO3 2- )>c(H2CO3) |
| B、在0.1 mol?L-1 Na2CO3溶液中:c(OH- )=c(HCO3- )+c(H2CO3)+c(H+ ) |
| C、某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子,该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| D、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2 Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2 Fe(SO4)2]<c[(NH4)2 SO4]<c(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol/L H2SO4 |
| B、0.5 mol/L NaOH |
| C、0.5 mol/L AgNO3 |
| D、0.5 mol/L NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清透明溶液中:Cl-、NO3-、Cu2+、NH4+ |
| B、水电离产生的c(OH-)=1×10-11mol/L的溶液:Cu2+、SO42-、NO3-、Cl- |
| C、中性溶液中:Fe3+、Al3+、NO3-、SO42- |
| D、能使苯酚变紫色的溶液:K+、Mg2+、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于98.32kJ |
| B、大于98.32kJ |
| C、小于98.32kJ |
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com