
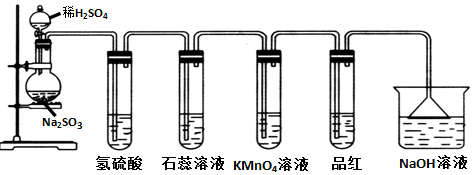
分析 Na2SO3固体与硫酸可发生反应:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,
(1)二氧化硫与氢硫酸反应生成单质硫;
(2)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸;酸可以使紫色石蕊试液变红;
(3)酸性KMnO4具有强氧化性,溶液颜色为紫色,SO2中+4价S具有还原性;
(4)二氧化硫与品红化合生成无色物质,能使品红溶液褪色,生成无色不稳定的大分子;
(5)二氧化硫是大气污染物,所以用NaOH溶液的作用是吸收多余的SO2防止污染环境,二氧化硫与氢氧化钠生成亚硫酸钠和水.
解答 解:(1)二氧化硫与氢硫酸反应生成单质硫,所以观察到产生黄色沉淀,体现二氧化硫的氧化性,故答案为:黄色沉淀; 氧化性;
(2)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸,可以使紫色石蕊试液变红,故答案为:变红;
(3)酸性KMnO4具有强氧化性,溶液颜色为紫色,SO2中+4价S具有还原性,二氧化硫通入酸性高锰酸钾中发生2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4,该反应中二氧化硫为还原剂,具有还原性,发生氧化反应,导致酸性KMnO4溶液褪色,
故答案为:紫红色褪去;还原;
(4)二氧化硫与品红化合生成无色物质,能使品红溶液褪色,故二氧化硫具有漂白性,加热所得溶液出现的实验现象是:恢复红色,故答案为:褪色;漂白;恢复红色;
(5)二氧化硫是大气污染物,所以用NaOH溶液的作用是吸收多余的SO2防止污染环境,二氧化硫与氢氧化钠生成亚硫酸钠和水,说明SO2是酸性氧化物,故答案为:吸收多余的SO2防止污染环境;酸性.
点评 本题考查了SO2的性质的实验设计和性质分析判断,掌握二氧化硫酸性氧化物性质、漂白性、氧化性和还原性等是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位 | |
| B. | 1 L 0.50 mol/L NH4Cl 溶液与2 L 0.25 mol/L NH4Cl 溶液含NH4+ 物质的量后者大 | |
| C. | 误将钡盐(主要为BaCl2)当作食盐食用时,常用0.5%的Na2SO4溶液解毒;溶洞、珊瑚的形成;泡沫灭火器“泡沫”产生的原理均可用沉淀溶解平衡原理来解释 | |
| D. | pH=4、浓度均为0.1 mol•L-1 的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 (25℃) | 1.8×10-5 | 3.0×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出 | |
| B. | 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 | |
| C. | 若X为电流计,Y为锌棒,则SO42-移向Fe棒 | |
| D. | 若X为导线,Y为铜棒,则Fe棒发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4 种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl=AgI=Ag2S | B. | AgCl<AgI<Ag2S | C. | AgCl>AgI>Ag2S | D. | AgI>AgCl>Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的氧化剂是ClO- | |
| B. | 反应生成l mol氧化产物时,转移的电子为6 mol | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com