
��ӦCH3OH ( l )+ NH3( g ) = CH3NH2( g ) + H2O ( g )��ij�¶��Է����ҽ��У�����Ӧ����H��= 17kJ/mol������H��T��S��= 17kJ/mol�����ڸ÷�Ӧ���й�ϵ��ȷ���ǣ� ��
A. ��H ��0����H�CT��S��0 B. ��H ��0����H�CT��S��0
C. ��H ��0����H�CT��S��0 D. ��H ��0����H�CT��S��0

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
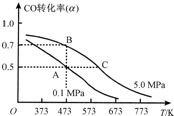 ��2013?����һģ����Ȼ����ú̿����CO��H2�����о����������൱�ձ飮������Ȼ���Ͷ�����̼�ɺϳɶ����ѣ���������ˮ������������Ϊȼ�ϵ�ص�����Դ�����������⼼���������ƣ���Ҫ��ӦΪ��
��2013?����һģ����Ȼ����ú̿����CO��H2�����о����������൱�ձ飮������Ȼ���Ͷ�����̼�ɺϳɶ����ѣ���������ˮ������������Ϊȼ�ϵ�ص�����Դ�����������⼼���������ƣ���Ҫ��ӦΪ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol CH3OCH3��1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH��Ũ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | ����a kJ | �ų�b kJ | �ų�c kJ |
| ƽ��ʱ�����L�� | V1 | V2 | V3 |
| ��Ӧ��ת���� | �� 1 | �� 2 | �� 3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com