
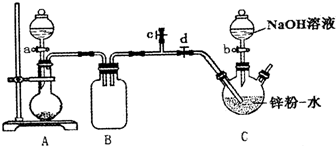
 保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.
保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
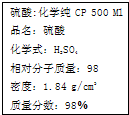
| A、该硫酸的物质的量浓度为9.2 mol/L |
| B、12gC与足量该硫酸共热反应,生成标准状况下气体体积为44.8L |
| C、1 mol Fe与足量的该硫酸反应产生2 g氢气 |
| D、配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三种分散系的分散质均能通过滤纸 |
| B、胶体在一定的条件下也能稳定存在 |
| C、溶液和胶体通常都是无色透明的液体,而浊液不透明 |
| D、胶体区别于其他分散系的本质特征是产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与普通碳原子的化学性质不同 |
| B、与14N含的中子数相同 |
| C、是金刚石的同素异形体 |
| D、与12C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | SO42- | NO3- |
| 浓度/mol?L-1 | 2×10-6 | 3×10-6 | 2×10-5 | 1.5×10-5 |
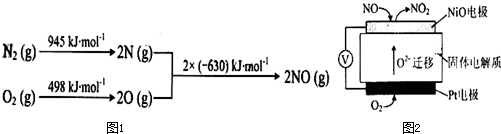
查看答案和解析>>
科目:高中化学 来源: 题型:
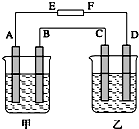 在如图中,甲烧杯中盛有100mL 0.50mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.25mol?L-1CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g,则
在如图中,甲烧杯中盛有100mL 0.50mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.25mol?L-1CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g,则查看答案和解析>>
科目:高中化学 来源: 题型:

| n(NO) |
| n(CO) |
| n(NO) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、3:5 |
| C、2:3 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com