
����Ŀ����ţ�̺ͽ�֭��ϣ���ţ�����̱��Ϊһ�ָ��й㶫��ɫ����Ʒ������ײ�̡�Ϊ������ţ�����������������ijͬѧ�ڲ�ͬ�¶ȵĵ���ţ���л���һЩ���ʽ�֭���۲�����15min�������Ƿ�����̣�������±�����ش��������⣺
�¶ȣ����� | 20 | 40 | 60 | 80 | 100 |
��� | 15min����δ�����̼��� | 14min����ȫ���� | 1min����ȫ���� | 1min����ȫ���� | 15min����δ�����̼��� |
��ע��������еĽ�֭�ظ�����ʵ�飬ţ�����κ��¶��¾��������̣�
��1��ʵ��֤�����ʽ�֭�к���һ��ø����������__��
��2��20����100��ʱ��15min����δ�����̼���˵��ø�Ļ��Խϵͣ���ԭ��ֱ���__��__��
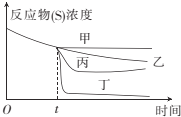
��3����60��ʱţ�����н�֭��û�н�֭������¶��������̣�����Ӧ���е�tʱ�������м��˽�֭����ͼ��ͼ������ȷ��ʾ�ӽ�֭��ţ��������ʱ��仯���Ƶ�������__��
��4��Ϊ���ʵ���ȷ�ȣ�ʵ��������ͬ�¶ȵĵ���ţ���л���һЩ���ʽ�֭��������Ӧע�����__��
��5����ͬѧ˵����ʵ�鲻�ܵó���֭ʹţ�����̵������¶ȣ���������������__��
���𰸡���10�֣���l��������״̬��ţ�̵�����ת���ɲ���״̬
��2��20��ʱ�¶Ƚϵͣ�ø�Ļ��Լ�����2�֣� l00��ʱ����ʹø�ṹ��ƻ�������ʧ�2�֣�
��3����
��4����������֭�ڲ�ͬ�¶��±��º������Ӧ�¶ȵ�ţ�̻�ϣ�2�֣�
��5����С�¶ȷ�Χ�������¶��ݶȣ�2�֣�
����������1��������ͼ��Ϣ��֪����ͬ�¶ȵĵ���ţ���л���һЩ���ʽ�֭�����¶Ȳ�ͬ����ʱ�䲻ͬ������ע���֪������еĽ�֭�ظ�����ʵ�飬ţ�����κ��¶��¾��������̣���˵�����ʽ�֭����һ��ø����ø�ܽ�����״̬��ţ�̵�����ת���ɲ���״̬��
��2��20��ø�Ļ��Խ���ø�ķ��ӽṹû����ƻ���ʧȥ���ԣ����¶����ߺ�ø�Ļ��Ի�ָ�����l00��ʱ����ʹø�ṹ��ƻ�������ʧ������Իָ���
��3��ţ���м��뽪֭�������ٶȴ����ߣ�Ѹ�����̣���ͼ�еĶ���
��4����������¾ͽ���֭��ţ�̻�ϣ�������ʹ�¶ȷ���һ���ı仯����˽�������֭�ڲ�ͬ�¶��±��º������Ӧ�¶ȵ�ţ�̻�ϣ��ܹ����ʵ���ȷ�ȡ�
��5��60����80����һ����ø�������¶ȣ��п�����70��ʱ������Ӿ�����ȫ���̣����Ҫ��С�¶ȷ�Χ�������¶��ݶȲſɵõ������¶ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ���֮�������ͼ��ʾ��ת����ϵ����ײ������ǣ� �� �� ![]() ��
�� ![]() ����
����
A.N2
B.C
C.Mg
D.Na
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1) д����ԭ�ӵĵ����Ų�ʽ_____________��
(2) ��ͪ(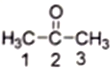 )������2��̼ԭ�ӵ��ӻ���ʽΪ__________����CS2��Ϊ�ȵ��������������__________(дһ��)��
)������2��̼ԭ�ӵ��ӻ���ʽΪ__________����CS2��Ϊ�ȵ��������������__________(дһ��)��
(3)��0.1mol[Cr(H2O)Cl]Cl2��H2O��ˮ��Һ��������������Һ��Ӧ����_______molAgCl������H2O���ӵļ��DZ�H2S���ӵļ��Ǵ�ԭ����_______ ��
(4) ��ͭ�����γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ(�ڵ����ͭԭ��)��

���þ���Ļ�ѧʽΪ_______��
���������ڵ�4���ڵ���������γɵ����幹����_______��
�۾�������һ����ԭ�Ӿ����������ԭ����_______����
����֪�þ�����ܶ�Ϊ��g.cm-3�������ӵ�������ֵΪNA����þ�����ͭԭ�Ӻ���ԭ��֮�����̾���Ϊ_______pm(�г�����ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪: Mg����NO2��ȼ�գ����ܲ���ΪMg3N2��MgO��N2��Mg3N2������ˮ��Ӧ��
(1) ijʵ��̽��С��̽��Mg��NO2��Ӧ�Ĺ������ɷ֣��Թ������������ּ���:
I.����Ϊ: �������ΪMgO��II.����Ϊ:________��III.����Ϊ: ________��
(2) ��С��ͨ������ʵ��װ������֤Mg��NO2��ȼ�շ�Ӧ����(�г�װ��ʡ�ԣ������������ظ�ʹ��
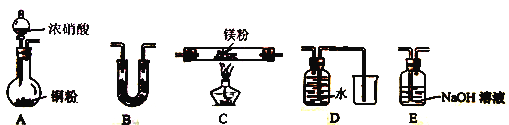
��ʵ��װ�����ӵ�˳��Ϊ____________(����ĸ���)��
��װ��B��ʢװ���Լ�������_______ (����ĸ)
a.Ũ���� b.��ʯ�� c.��ˮCaCl2 d.����������
��ȷ����������N2���ɵ�ʵ������Ϊ_____________________��
(3)���ʵ��֤��: �����д���Mg3N2: ____________________��
(4)��֪װ��C�г�ʼ����Mg������Ϊ13.2g,��������NO2�г��ȼ�գ�ʵ�������Ӳ�ʲ�������ȴ�����¡����������Ӳ�ʲ�������ʣ����������Ϊ21.0g,����N2�����Ϊ1120mL(��״��)��д���������з�����Ӧ�Ļ�ѧ����ʽ:_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����K2SO4��Al2(SO4)3�Ļ����Һ����֪����Al3��Ũ��Ϊ0.4 mol/L��SO42-��Ũ��Ϊ0.7 mol/L�������Һ��K����Ũ��Ϊ(����)
A. 0.1 mol/L B. 0.15 mol/L C. 0.2 mol/L D. 0.25 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������ͼװ�ý����к��ȵIJⶨ����ش��������⣺
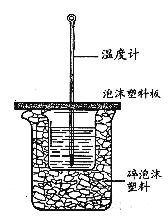
��1����С�ձ�֮����������ĭ���ϵ�������___________����1���������к��Ȳⶨʵ�飬�¶ȼ���ʹ��________��,��ʵ��װ���Ͽ���ͼ��ȱ�ٵ�һ�ֲ���������______________ ��
��2��ʹ�ò�ȫ�������װ�ý���ʵ�飬ȡ50mL0.25mol��LH2SO4��Һ�� 50mL0.55 mol��L NaOH��Һ��С�ձ��н����кͷ�Ӧ������ʵ���¶�ƽ������3.4�档��֪�кͺ����ɵ���Һ�ı�����cΪ 4.18J�� (g����)����Һ���ܶȾ�Ϊ1g��cm3��ͨ������ɵ��к��ȡ�H= ______ �� H2SO4��NaOH��Ӧ���Ȼ�ѧ����ʽ_______________ ��
��3��ʵ��������60mL0��25mol��L��1H2SO4��Һ��50mL0��55mol��L��1NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������___________ (��������������������)�������к���___________(��������������������)������50mL0��50mol��L��1�������H2SO4��Һ��������ʵ�飬��÷�Ӧǰ���¶ȵı仯ֵ��_______��(����ƫ��������ƫС����������Ӱ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪1g������ȫȼ������ˮ����ʱ�ų�����121kJ����������1molO=O����ȫ����ʱ��������496kJ��ˮ������1mol H��O���γ�ʱ�ų�����463kJ����������1mol H��H������ʱ��������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ɫ���������Ư�����йص���( )
A.��ˮB.�����̪������������Һ
C.���Ը��������ҺD.Ʒ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20��ʱ����������BaSO4��������50mLˮ�У���ֽ��裬��������Na2CO3���壬���裬��Һ����c(CO32-)����ʱc(Ba2+)�仯��������ͼ��������˵��ȷ����
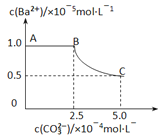
A. 20��ʱKsp(BaSO4)��Ksp(BaCO3)
B. ����Na2CO3����������BaCO3��������
C. BaCO3��Ksp=2.5��10-10
D. ����BC���ڣ�c(CO32-)��c(SO42-)=25
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com