
·ÖĪö £Ø1£©Al3+”¢Fe3+Ė®½āŠĪ³É½ŗĢ壬½ŗĢå¾ßÓŠĪüø½ŠŌ£»
£Ø2£©øł¾Ż»ÆŗĻĪļÖŠø÷ŌŖĖŲ»ÆŗĻ¼ŪµÄ“śŹżŗĶĪŖ0Č·¶ØÕā¼øøö×ÖÄøÖ®¼äµÄ¹ŲĻµ£»
£Ø3£©¢Ł½Į°čæÉŅŌŹĒ·“Ó¦Īļ»ģŗĻ¾łŌČ£»
¢Śøł¾ŻĻūŗĵÄŃĪĖį¼ĘĖćn£ØOH-£©£¬øł¾ŻÓėBaCl2·“Ó¦³ĮµķµÄ³ĮµķµÄÖŹĮæĒó³ön£ØSO42-£©£¬øł¾ŻÓėµāĄė×Ó·“Ó¦µÄ¹ŲĻµĒó³ön£ØFe3+£©£¬øł¾ŻµēŗÉŹŲŗć¼ĘĖćn£ØAl3+£©£¬ŌŁøł¾Ż×ÜÖŹĮæĒó³öĖ®µÄÖŹĮæ¼°ĪļÖŹµÄĮ棬øł¾ŻĪļÖŹµÄĮæÖ®±ČČ·¶Ø»ÆѧŹ½£®
½ā“š ½ā£ŗ£Ø1£©¾ŪŗĻĮņĖįĀĮĢś[AlaFeb£ØOH£©m£ØSO4£©n•xH2O]ŌŚĖ®ÖŠÄܹ»µēĄė³öAl3+”¢Fe3+£¬Al3+”¢Fe3+Ė®½āŠĪ³É½ŗĢ壬½ŗĢå¾ßÓŠĪüø½ŠŌ£¬Äܹ»Īüø½Ė®ÖŠµÄŠüø”æÅĮ££¬“Ó¶ųĘšµ½¾»Ė®µÄ×÷ÓĆ£¬
¹Ź“š°øĪŖ£ŗ¾ŪŗĻĮņĖįĀĮĢśČÜÓŚĖ®µēĄėµÄAl3+”¢Fe3+æÉŅŌĖ®½āŠĪ³É½ŗĢ壬¾ßÓŠĪüø½ŠŌ£»
£Ø2£©AlaFeb£ØOH£©m£ØSO4£©n•xH2OÖŠÖŠø÷ŌŖĖŲ»ÆŗĻ¼ŪµÄ“śŹżŗĶĪŖ0£¬ĖłŅŌ3a+3b+£Ø-1£©”Įm+£Ø-2£©”Į2=0£¬ĖłŅŌµĆ3a+3b=m+2n£¬
¹Ź“š°øĪŖ£ŗ3a+3b=m+2n£»
£Ø3£©¢Ł½Į°čæÉŅŌŹĒ·“Ó¦Īļ»ģŗĻ¾łŌČ£¬ÓŠĄūÓŚ·“Ó¦Īļ³ä·Ö½Ó“„£¬Ź¹·“Ó¦ĪļĶźČ«·“Ó¦£¬
¹Ź“š°øĪŖ£ŗ»ģŌČ·“Ó¦Īļ£¬Č·±£·“Ó¦ĶźČ«£»
¢Śn£ØOH-£©=2n£ØH2SO4£©=0.15L”Į0.100mol•L-1”Į2=0.03mol£¬
n£ØSO42-£©=n£ØBaSO4£©-n£ØH2SO4£©=$\frac{10.4850g}{233g/mol}$-0.15L”Į0.100mol•L-1=0.03mol£¬
ŅŃÖŖ£ŗI2+2Na2S2O3=2NaI+Na2S4O6£¬2Fe3++2I-=2Fe2++I2£¬
Ōņ2Fe3+”«I2”«2Na2S2O3£¬
n£ØFe3+£©=n£ØNa2S2O3£©=0.02L”Į0.500mol•L-1=0.01mol£¬
ŌŚAlaFeb£ØOH£©m£ØSO4£©nÖŠĄė×ÓĖł“ųµēŗÉŹŲŗć£¬Ōņn£ØAl3+£©=$\frac{1}{3}$”Į£Ø0.03mol+0.03mol”Į2-0.01mol”Į3£©=0.02mol£»
8.810gѳʷ֊Ė®µÄÖŹĮæ£ŗm£ØH2O£©=8.810g-0.02mol”Į27g•mol-1-0.01mol”Į56g•mol-1-0.03mol”Į17g•mol-1-0.03mol”Į56g•mol-1=4.32g£¬
Ōņn£ØH2O£©=$\frac{4£¬32g}{18g/mol}$=0.24mol£¬
ĖłŅŌn£ØAl3+£©£ŗn£ØFe3+£©£ŗn£ØOH-£©£ŗn£ØSO42-£©£ŗn£ØH2O£©=2£ŗ1£ŗ3£ŗ3£ŗ24
ŌņĮņĖįĀĮĢśµÄ»ÆѧŹ½ĪŖAl2Fe£ØOH£©3£ØSO4£©3•24H2O£¬
¹Ź“š°øĪŖ£ŗAl2Fe£ØOH£©3£ØSO4£©3•24H2O£®
µćĘĄ ±¾Ģāæ¼²éĮĖĢ½¾æĪļÖŹµÄ×é³É”¢½ŗĢåµÄŠŌÖŹ”¢»ÆŗĻĪļÖŠ»ÆŗĻ¼ŪµÄ¹ŲĻµµČ£¬ĢāÄæÄѶČÖŠµČ£¬²ąÖŲÓŚæ¼²éѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦£¬×¢Ņā°ŃĪÕĪļÖŹ»ÆѧŹ½µÄČ·¶Ø·½·Ø£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | V1£¾V2 | B£® | V1£¼V2 | C£® | V1=V2 | D£® | V1”ÜV2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ėį¼īÖŠŗĶµĪ¶ØÖÕµćµÄpHÖµŅ»¶ØµČÓŚ7 | |
| B£® | µĪ¶ØŹµŃé֊׶ŠĪĘæ²»æÉÓĆ“ż²āŅŗČóĻ“ | |
| C£® | µĪ¶ØŹµŃéÖŠ£¬KMnO4ČÜŅŗÓ¦·ÅŌŚ¼īŹ½µĪ¶Ø¹ÜÖŠ | |
| D£® | 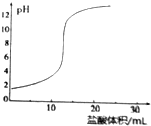 ÓĆŃĪĖįµĪ¶ØNaOHČÜŅŗµÄµĪ¶ØĒśĻßČēĶ¼ĖłŹ¾ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
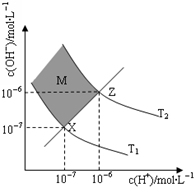 “×ĖįŗĶŃĪĖįŹĒČÕ³£Éś»īÖŠ¼«ĪŖ³£¼ūµÄĖį£¬ŌŚŅ»¶ØĢõ¼žĻĀCH3COOHČÜŅŗÖŠ“ęŌŚµēĄėĘ½ŗā£ŗCH3COOH?CH3COO-+H+”÷H£¾0
“×ĖįŗĶŃĪĖįŹĒČÕ³£Éś»īÖŠ¼«ĪŖ³£¼ūµÄĖį£¬ŌŚŅ»¶ØĢõ¼žĻĀCH3COOHČÜŅŗÖŠ“ęŌŚµēĄėĘ½ŗā£ŗCH3COOH?CH3COO-+H+”÷H£¾0²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŹÆÄ«±Č½šøÕŹÆĪČ¶Ø | B£® | ½šøÕŹÆ±ČŹÆÄ«ĪČ¶Ø | ||
| C£® | ŹÆÄ«×Ŗ»ÆĪŖ½šøÕŹÆŹĒŅ»øöĪļĄķ±ä»Æ | D£® | ŹÆÄ«ŗĶ½šøÕŹÆŹĒĶ¬Ņ»ÖÖĪļÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | COµÄČ¼ÉÕČČĪŖ566kJ•mol-1 | |
| B£® | 2 mol COŗĶ1 mol O2µÄ×ÜÄÜĮæ±Č2 mol CO2µÄ×ÜÄÜĮæµĶ | |
| C£® | 2CH3OH£Øl£©+3O2£Øg£©=2CO2£Øg£©+4H2O£Øg£©”÷H=-1453.28 kJ•mol-1 | |
| D£® | ĶźČ«Č¼ÉÕ16g¼×“¼£¬Éś³ÉŅ»Ńõ»ÆĢ¼ŗĶĖ®Ź±·Å³öµÄČČĮæĪŖ221.82 kJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĆæŅ»øöĖ®·Ö×ÓÄŚŗ¬ÓŠĮ½øöĒā¼ü | |
| B£® | Ēā¼üÖ»ÄÜ“ęŌŚÓŚ·Ö×ÓÖ®¼ä | |
| C£® | DNAÖŠµÄ¼ī»ł»„²¹Åä¶ŌŹĒĶعżĒā¼üĄ“ŹµĻÖµÄ | |
| D£® | HFŹĒŅ»ÖÖ·Ē³£ĪČ¶ØµÄ»ÆŗĻĪļ£¬ÕāŹĒÓÉĒā¼üĖłÖĀ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
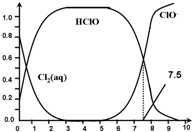
| A£® | Cl2£Øg£©+H2O?2H++ClO-+Cl- K=10-12.1 | |
| B£® | ŌŚĀČ“¦ĄķĖ®ĢåĻµÖŠ£¬c£ØHClO£©+c£ØClO-£©=c£ØH+£©-c£ØOH-£© | |
| C£® | ÓĆĀČ“¦ĄķŅūÓĆĖ®Ź±£¬pH=7.5Ź±É±¾śŠ§¹ū±ČpH=6.5Ź±ŗĆ | |
| D£® | ĀČ“¦ĄķŅūÓĆĖ®Ź±£¬ŌŚĻļ¾µÄɱ¾śŠ§¹ū±ČŌŚ¶¬¼¾ŗĆ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com