
| A. | 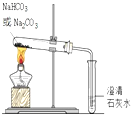 鉴别碳酸钠和碳酸氢钠 | B. | 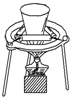 钠的燃烧 | ||
| C. | 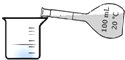 量取100.00mL溶液 | D. | 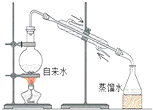 实验室制取蒸馏水 |
分析 A.碳酸氢钠加热分解,而碳酸钠不分解;
B.钠燃烧放出大量的热,可在坩埚中进行;
C.量取溶液应选择量筒、移液管等;
D.制取蒸馏水,选择蒸馏装置.
解答 解:A.碳酸氢钠加热分解,而碳酸钠不分解,则图中加热装置及检验装置合理,使石灰水变浑浊的为碳酸氢钠,可鉴别,故A正确;
B.钠燃烧放出大量的热,可在坩埚中进行,在玻璃仪器中易发生仪器炸裂,图中坩埚、泥三角、三脚架均合理,故B正确;
C.量取溶液应选择量筒、移液管等,不能利用容量瓶量取溶液,容量瓶只能配制溶液,故C错误;
D.制取蒸馏水,选择蒸馏装置,图中仪器、冷却水方向均合理,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、检验及实验基本操作等,把握物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z |
| A. | X和Y都是非金属元素,其中X最高化合价为+5 | |
| B. | X、W的最高价氧化物在一定条件下能反应 | |
| C. | 元素X、W和氧元素可形成化学式为W2XO3,离子化合物 | |
| D. | Y、Z的氢化物的稳定性Y<2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
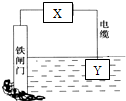
| A. | 若X为导线,Y可以是锌 | |
| B. | 若X为导线,铁闸门上的电极反应式为Fe-2e→Fe2+ | |
| C. | 若X为直流电源,铁闸门做负极 | |
| D. | 若X为直流电源,Y极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2-的离子半径大于W3+的离子半径 | |
| B. | Y、Z形成的化合物为离子化合物 | |
| C. | Z的最高价氧化物对应的水化物的酸性比X的强 | |
| D. | X的气态简单氢化物的稳定性比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物炼铜比高温炼铜更清洁、成本更低 | |
| B. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| C. | 用福尔马林灭活埃博拉病毒是利用了蛋白质变性原理 | |
| D. | 扫描隧道显微技术、超分辨率荧光显微技术等技术的发展促进了人类对物质微观结构的探索,使科学研究迈入更高水平层次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
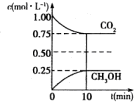 (1)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3molH2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-aKJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
(1)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3molH2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-aKJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH试纸直接放入某溶液中,测定该溶液的pH | |
| B. | 用澄清石灰水鉴别NaHCO3和Na2CO3 | |
| C. | 过滤操作时,漏斗下部的尖嘴要紧靠烧杯的内壁 | |
| D. | 从碘水提取碘可用乙醇作萃取剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com