
| A. | 2LSO2和2LCO2 | B. | 9 g水和标准状况下 11.2LCO2 | ||
| C. | 标准状况下1mol氧气和 22.4L水 | D. | 0.1mol氢气和 2.24L氯化氢气体 |
分析 A、相同条件下,等体积的两种气体分子数相等;
B、根据n=$\frac{m}{M}$和n=$\frac{V}{{V}_{m}}$进行计算求解;
C、水在标况下是液体;
D、状况不知无法由体积求物质的量.
解答 解:A、条件不确定,所以分子数不一定相同,故A错误;
B、n=$\frac{m}{M}$=$\frac{9g}{18g/mol}$=0.5mol和n=$\frac{V}{{V}_{m}}$=$\frac{11.2L}{22.4L/mol}$=0.05mol,所以分子数相同,故B正确;
C、水在标况下是液体,故C错误;
D、状况不知无法由体积求物质的量,所以2.24L氯化氢气体物质的量不知,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关问题,注意物质与微粒的关系,注意单位的运用,题目较简单.


科目:高中化学 来源: 题型:多选题
| A. | 与铝反应产生氢气的溶液中:Na+、NH4+、SO42-、CH3C00- | |
| B. | c(Fe3+)=0.1mol•L-1的溶液中:NH4+、Cl-、AlO2-、SO42- | |
| C. | 使甲基橙变红的溶液中:K+、Al3+、SO42-、NO3- | |
| D. | 由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
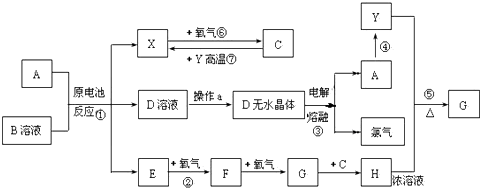
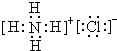
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
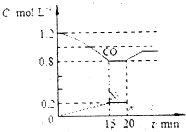 CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题
CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
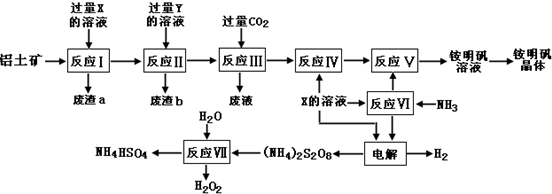
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
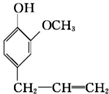 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: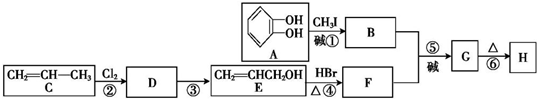
 +RX$\stackrel{碱}{→}$
+RX$\stackrel{碱}{→}$ +HX(X代表卤素原子);
+HX(X代表卤素原子); .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
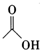 +
+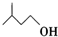 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ 
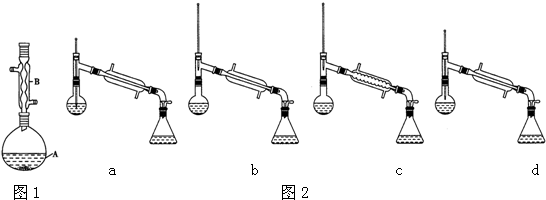
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40Wg | B. | 80ng | C. | 5(m-n)g | D. | mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com