
维生素A的结构简式如右图所示,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来。关于它的叙述正确的是( )
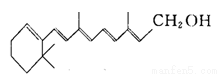
A.维生素A的分子式为C20H28O
B.维生素A是一种易溶于水的醇
C.维生素A能与酸发生酯化反应
D.1 mol维生素A在催化剂作用下最多可与7 mol H2发生加成反应
科目:高中化学 来源:2015-2016学年江西省赣州市十三县(市)高二下期中化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,22.4L H2S全部溶于水所得溶液中HS-和S2-离子数之和为NA
B.含4mol HCl的浓盐酸与足量二氧化锰反应转移的电子总数为2NA
C.11g T2O含有的电子数为5NA
D.常温下,0.2L 0.5mol/L NH4NO3溶液的氮原子数小于0.2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省娄底市双峰县高一下期中化学试卷(解析版) 题型:填空题
W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性。请回答下列问题:
(1)Y在元素周期表中的位置为_________,上述元素的最高价氧化物对应的水化物酸性最强的是_____(写化学式),W、Y、Z、M形成的简单离子的半径大小顺序是___________________(用化学符号表示),G的离子结构示意图:_______________。
(2) Y与M的氢化物中,热稳定性更好的是____________(填化学式),原因是____________________________________________________________。
(3)Z2Y2的电子式为__________,ZW与水反应放出气体的化学方程式为_______________________________________________________________________。
(4)X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式________________________,指出电解质溶液中OH-离子向________极移动。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省娄底市双峰县高一下期中化学试卷(解析版) 题型:选择题
下列微粒中,与NH4+的电子总数和质子总数都相同的是( )
A.Na+ B.F C.OH- D.CH4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高二下期中理科化学试卷(解析版) 题型:选择题
有机物X、Y的分子式不同,它们都只含C、H、O元素中的两种或三种,等物质的量的X和Y完全燃烧时消耗氧气和生成的二氧化碳的物质的量均相同,X、Y可能是( )
A.C2H4、C2H6O B.C2H2、C6H6
C.CH2O、C3H6O2 D.CH4、C2H4O2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高二下期中理科化学试卷(解析版) 题型:选择题
按系统命名法,物质 的正确的名称是( )
的正确的名称是( )
A.3,4,4-三甲基己烷 B.3,3-二甲基-2-乙基戊烷
C.3,3,4-三甲基己烷 D.3,3-二甲基-4-乙基戊烷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:填空题
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物CE在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是________(用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为__________,其中存在的化学键类型为____________;
(4)单质E与水反应的离子方程式为________________.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
下列过程中,离子键被破坏的是( )
A.干冰升华 B. HNO3溶于水 C.NaCl溶于水 D.HCl气体溶于水
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省枣阳市高二下期中化学试卷(解析版) 题型:选择题
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是( )

A.T°C时,该反应的平衡常数值为4
B.c点没有达到平衡,此时反应向逆向进行
C.若c点为平衡点,则此时容器内的温度高于T°C
D.T°C时,直线cd上的点均为平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com