
����Ŀ����������ʵ��������������ó��Ľ�����ȷ����(����)
ѡ�� | ʵ����������� | ���� |
A | ��ʢ����������ϡ��Һ���Թ�����μ��뱥����ˮ��������ɫ���� | ������Br2��Ӧ����2��4��6���屽�� |
B | ��H2O2��Һ�е���NaClO��Һ��������ɫ���� | H2O2���������� |
C | ��FeCl3��Һ�е�������KI��Һ���ټ���KSCN��Һ����Һ��� | Fe3����I���ķ�Ӧ���п����� |
D | �������еμ�����Ũ���ᣬ���裬���DZ�ڣ�������ɣ�������ɶ�ĺ���״ | Ũ���������ˮ�Ժ������� |
A. AB. BC. CD. D
���𰸡�AD
��������
A.����������ϡ��Һ����μ��뱥����ˮ������ȡ����Ӧ���������屽�Ӱ�ɫ��������Ӧ����ʽΪ��![]() +3Br2��
+3Br2��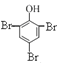 ��+3HBr��A��ȷ��
��+3HBr��A��ȷ��
B.NaClO�������������⣬����������֤������������л�ԭ�ԣ�B����
C.FeCl3��Һ�е�������KI��Һ���Ȼ������������������жϿ��淴Ӧ��C����
D.Ũ����ʹ������ˮ������C������Ũ���ᷢ��������ԭ��Ӧ����SO2��CO2��ˮ�����������DZ�ڣ�������ɣ�������ɶ�ĺ���״��֤��Ũ���������ˮ�Ժ������ԣ�D��ȷ��
�ʺ���ѡ����AD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Cl2ͨ��һ��Ũ�ȵĿ��Լ���Һ�У�����ǡ����ȫ��Ӧ(��֪��Ӧ���̷���)���������������ֺ���Ԫ�ص����ӣ�����ClO����ClO3���������ӵ����ʵ���(n)�뷴Ӧʱ��(t)�ı仯ʾ��ͼ��ͼ��ʾ������˵����ȷ����
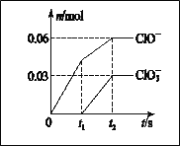
A. ���Լ���Һ��KOH��������4.94 g
B. ��Ӧ��ת�Ƶ��ӵ����ʵ�����0.09 mol
C. ������ClO����ClO3��
D. ClO3���������������¶����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. ![]() ���庬�����ӵ���ĿΪ
���庬�����ӵ���ĿΪ![]()
B. �����£�![]() �Ĵ�����Һ��H+��ĿΪ
�Ĵ�����Һ��H+��ĿΪ![]()
C. 13g��![]() C��
C��![]() ��ɵ�̼����������������һ��Ϊ
��ɵ�̼����������������һ��Ϊ![]()
D. ![]() ������
������![]() ��һ�������»��ϣ�ת�Ƶ�����Ϊ
��һ�������»��ϣ�ת�Ƶ�����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. ��ͭ��⾫��ʱ����ͭ����ͭ���ηֱ�������������
B. 5.6 g Fe������Cl2�г��ȼ�գ�ת�Ƶ��ӵ���ĿΪ0.2��6.02��1023
C. �����£�ϡ��0.1 mol/L NH4Cl��Һ����Һ��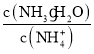 ����
����
D. ��BaCO3��BaSO4�ı�����Һ�м�������BaCl2����Һ��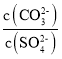 ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ,����˵������ȷ����
A. 28g������к���Si��Si���ĸ���Ϊ2NA
B. 12gʯī�����к���C��C���ĸ���Ϊ3NA
C. 31g�����к���P��P���ĸ���ΪNA
D. SiO2������1molSi����O�γ�2NA�����ۼ�(Si��O��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NVCO{��ѧʽ�ɱ�ʾΪ(NH4)a[(VO)b(CO3)c(OH)d]��10H2O}��������ȡVO2��ʵ���ҿ���V2O5��N2H4��2HCl��NH4HCO3Ϊԭ���Ʊ�NVCO��
(1)ԭ��NH4HCO3��HCO3-ˮ������ӷ���ʽΪ____________��
(2) N2H4��2HCl��N2H4�������Ρ���֪N2H4��ˮ�еĵ��뷽ʽ��NH3���ƣ�25 ��ʱ��K1=9.55��10-7�����¶��£���ӦN2H4+H��![]() N2H5+��ƽ�ⳣ��K=________(����ֵ)��
N2H5+��ƽ�ⳣ��K=________(����ֵ)��
(3)Ϊȷ��NVCO����ɣ���������ʵ�飺
�ٳ�ȡ2.130 g��Ʒ������NaOH��ַ�Ӧ������NH3 0.224 L(�ѻ���ɱ�״����)��
����ȡһ������Ʒ�ڵ������м��ȣ���Ʒ�Ĺ��������(������Ʒ��ʣ������/������Ʒ����ʼ������100%)���¶ȵı仯����ͼ��ʾ(�ֽ�����и�Ԫ�صĻ��ϼ۲���)��
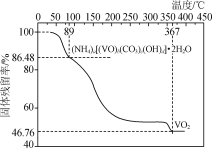
��������ʵ�����ݼ���ȷ��NVCO�Ļ�ѧʽ(д���������)________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӱ�컯ѧ��Ӧ���ʵ����غܶ�,ij������ȤС����ʵ��ķ�������̽����
ʵ��һ:ȡ�����ʵ���Ũ�ȵ����H2O2��Һ�ֱ��������ʵ��,ʵ�鱨�����±���ʾ��

��� | ���� | ���� | ���� | |
�¶�/�� | ���� | |||
1 | 40 | FeCl3��Һ | ||
2 | 20 | FeCl3��Һ | ||
3 | 20 | MnO2 | ||
4 | 20 | �� | ||
��1��ʵ��1��2��Ŀ�����о�__________���ض�H2O2�ֽ����ʵ�Ӱ�졣
��2��ʵ��1��Ӧ�Ļ�ѧ����ʽΪ___________________________��
ʵ���:���о�֪Cu2+��H2O2�ֽ�Ҳ���д�����,Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч��,��С���ͬѧ�ֱ��������ͼ��ʾ��ʵ�顣��ͨ���۲�_________�ó����ۡ� ��ͬѧ�����FeCl3��ΪFe2(SO4)3��Ϊ����,��������____________________��
ʵ����:��֪�ڸ�����أ�KMnO4��������Һ�Ͳ��ᣨH2C2O4����Һ��Ӧʱ,���ֿ�ʼһ��ʱ��,��Ӧ���ʽ���,��Һ��ɫ�����ԣ�������ͻȻ��ɫ,��Ӧ�������Լӿ졣
��1��д�������ữ�ĸ��������Һ�Ͳ�����Һ��Ӧ�Ļ�ѧ����ʽ____________
��2���������ʵ������,ijͬѧ��ΪKMnO4��H2C2O4��Ӧ�Ƿ��ȷ�Ӧ,������Һ�¶�����,��Ӧ���ʼӿ졣��Ӱ�컯ѧ��Ӧ���ʵ����ؿ�,��IJ��뻹������______��
��3������ʵ��֤����IJ���/span>,�����Ը��������Һ��������Һ�Լ���,����Ҫѡ����Լ����������__________��
A������� B�������� C��ˮ D���Ȼ���
��4����ʵ������н�2.0mL0.10mol/LH2C2O4��Һ��4.0mL0.010mol/L����KMnO4��Һ��ϣ�������Һ��Ϻ�����ı仯���������Һ����ɫʱ��Ϊ40s,���ʱ����ƽ����Ӧ����v(KMnO4)=__________mol��L-1��min-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2SO2(g)��O2(g)![]() 2SO3(g)����H ����197 kJ��mol��1����25 ��ʱ�����ѹ�ܱ�������ͨ��2 mol SO2��1 mol O2���ﵽƽ��ʱ�ų�����a1����25 ��ʱ���ڴ˺�ѹ�ܱ�������ֻͨ��1 mol SO2��0.5 mol O2���ﵽƽ��ʱ�ų�����a2�������й�ϵ��ȷ����(����)
2SO3(g)����H ����197 kJ��mol��1����25 ��ʱ�����ѹ�ܱ�������ͨ��2 mol SO2��1 mol O2���ﵽƽ��ʱ�ų�����a1����25 ��ʱ���ڴ˺�ѹ�ܱ�������ֻͨ��1 mol SO2��0.5 mol O2���ﵽƽ��ʱ�ų�����a2�������й�ϵ��ȷ����(����)
A. 2a2��a1��197 kJ B. 2a2��a1��197 kJ
C. a2��a1��197 kJ D. 197 kJ��a1��2a2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽ��
SO2��g����1/2O2��g��![]() SO3��g����H����98��32 kJ/mol���������г���2 mol SO2��1 mol O2��ַ�Ӧ�����շų�������Ϊ
SO3��g����H����98��32 kJ/mol���������г���2 mol SO2��1 mol O2��ַ�Ӧ�����շų�������Ϊ
A. 196��64 kJ B. 196��64 kJ/mol C. ��196��64 kJ D. ��196��64 kJ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com