
【题目】已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( ) 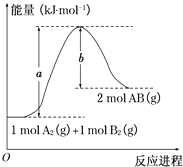
A.每生成2分子AB吸收b kJ热量
B.该反应热△H=+(a﹣b)kJmol﹣1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A﹣A和1 mol B﹣B键,放出a kJ能量
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】氯元素的单质及其化合物在生产生活中应用极其广泛.请完成下列填空: 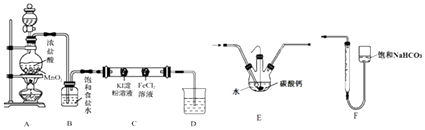
(1)氯气性质探究
设计如图实验装置来制备并验证氯气的性质(部分夹持装置未画出).
(i)A中放置固体二氧化锰的装置名称是 .
(ii)装置B的作用是 .
(iii)硬质玻璃管C中事先装有两个沾有相关试剂的棉球,左侧棉球的实验现象为 .
(iv)D中的NaOH溶液用来吸收尾气,向反应后的D中加入足量稀硫酸会产生气体,写出该反应的离子方程式 .
(2)制备HClO
设计装置E代替如图的装置C,用于制备较高浓度的HClO溶液.在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙.
①该方案可以制得较高浓度HClO的原因是(结合必要的化学语言回答) .
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除HClO外,还含有、(写两种钙盐的化学式,一种正盐,一种酸式盐);该小组同学测得反应中碳酸钙质量减少M g,反应后从所得的200mL溶液中取用10mL与足量稀盐酸混合,连接F装置测得产生的气体体积为V L(已换算成标准状况),则原溶液中含钙正盐的浓度为molL﹣1(用含M、V的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,可以加快Fe与稀H2SO4反应速率的是
A. 往溶液中加入少量水
B. 往溶液中加入少量FeSO4固体
C. 往溶液中加入少量较浓H2SO4
D. 用98%的浓硫酸代替稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2 (g)+2H2O(g)△H1=﹣574kJmol﹣1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1
下列选项正确的是( )
A.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJmol﹣1
B.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)的反应热为△H3 , 则△H3>△H1
C.若用0.2molCH4还原NO2至N2 , 则反应中放出的热量一定为173.4kJ
D.若用标准状况下2.24LCH4还原NO2至N2 , 整个过程中转移的电子为1.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池,装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:
2Na2S2+NaBr3 ![]() Na2S4+3NaBr,当闭合K时,X极附近溶液变红色.
Na2S4+3NaBr,当闭合K时,X极附近溶液变红色.
下列说法正确的是( )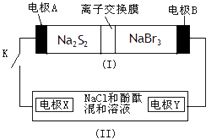
A.装置(I)中Na+从右到左通过离子交换膜
B.A电极的电极反应式为:NaBr3+2Na++2e﹣=3NaBr
C.X电极的电极反应式为:2Cl﹣﹣2e﹣=Cl2↑
D.每有0.1mol Na+通过离子交换膜,X电极上就生成标准状况下气体1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A.用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
B.超导材料AB2在熔融状态下能导电,说明AB2是电解质
C.推广使用煤液化技术可以减少温室气体二氧化碳的排放
D.人体摄入的糖类、油脂、蛋白质均必须先经过水解才能被吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )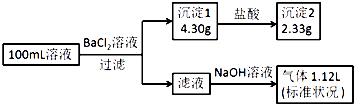
A.原溶液一定存在CO32﹣和SO42﹣ , 一定不存在Fe3+
B.原溶液一定存在Cl﹣ , 可能存在Na+
C.原溶液中c(Cl﹣)≥0.1molL﹣1
D.若原溶液中不存在Na+ , 则c(Cl﹣)<0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)D(g)+E(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的物质的量如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T1℃时,该反应的平衡常数K=;
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是(填字母编号).
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2molB、0.1molD,0.1molE
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为如图中的(填序号) 
(4)维持容器的体积和温度T1不变,当向该容器中加入1.60molB,0.20molD,0.20molE和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n取值范围mol.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a= .
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图所示由图可知,Q0(填“大于”或“小于”),c点v正v逆(填“大于”、“小于”或“等于”.) 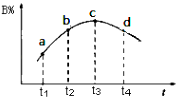
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:mA(气)+nB(气)pC(气)(焓变为△H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图1,2所示,下列结论正确的是( ) 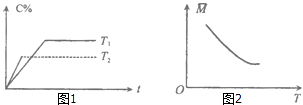
A.m+n>p,△H>0
B.m+n>p,△H<0
C.m+n<p,△H>0
D.m+n<p,△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com