
| A、用铁矿石冶炼铁 |
| B、用Na2SiO3溶液制取硅胶干燥剂 |
| C、对FeCl2溶液与NaOH溶液反应后的沉淀进行过滤 |
| D、夏天食物变质 |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
| A、氧化性 | B、还原性 |
| C、酸性 | D、碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:10:100:1 000 |
| B、0:1:12:11 |
| C、14:13:12:11 |
| D、14:13:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | N-H | N-N | O═O | N≡N | O-H |
| 键能(kJ/mol) | 386 | 167 | 498 | 946 | 460 |
查看答案和解析>>
科目:高中化学 来源: 题型:
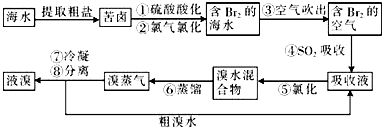
查看答案和解析>>
科目:高中化学 来源: 题型:
A、MgCl2(熔融)
| ||||
B、2AlCl3(熔融)
| ||||
C、HgO+CO
| ||||
D、2MgO+C
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com