
【题目】(1)氢气是一种未来十分理想的能源。
镧镍合金是一种良好的储氢材料,在一定条件下通过如下反应实现储氢:
LaNi3(s)+3H2(g) ![]() LaNi3H6(s) H<0。 某实验室模拟该过程,向体积一定的密闭容器中充入反应物发生反应。H2的平衡转化率与其初始加入量(n)、反应温度(T)的关系如下左图所示;一定温度(T)下,将a mol的氢气充入体积是1 L的容器内,气体的压强(P)随时间(t)的变化关系如下右图所示:
LaNi3H6(s) H<0。 某实验室模拟该过程,向体积一定的密闭容器中充入反应物发生反应。H2的平衡转化率与其初始加入量(n)、反应温度(T)的关系如下左图所示;一定温度(T)下,将a mol的氢气充入体积是1 L的容器内,气体的压强(P)随时间(t)的变化关系如下右图所示:

①n1、n2、n3的大小关系是_______。
②温度T1下反应的平衡常数是__________(用含a的代数式表示)。
③保持温度不变,在t6时刻将容积压缩至原容积的一半,容器内的压强_________6kPa(填写“大于”或“小于”)。
(2)贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应①![]()
②![]()
③![]()
![]() _______。
_______。
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应②(已排除其他反应干扰),测得CO(g)物质的量分数随时间变化如下表所示:

若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0-5分钟内的速率v[H2O(g)]=______。6分钟时,仅改变一种条件破坏了平衡,且第9min达到平衡时,CO的物质的量是0.2mol,则改变的外界条件为_________。
(4)温度、压强对反应CO(g)十2H2(g)=CH3OH(g) H=-90. 1 kJ·mol-1中CO转化率的影响如图所示:

①温度在较低范围内,对CO转化率影响的主要因素是____________ (填“温度”或“压强”)。
②由图像可知,温度越低,压强越大,CO转化率越高。但实际生产往往采用300~400 °C和10 MPa的条件,其原因是________。
【答案】n1<n2<n3 ![]() 小于 -206 kJ·mol-1 0.032mol/L 降低温度 温度 温度太低,反应速率太慢,不利于甲醇的合成,压强太大,设备要求提高,成本增加
小于 -206 kJ·mol-1 0.032mol/L 降低温度 温度 温度太低,反应速率太慢,不利于甲醇的合成,压强太大,设备要求提高,成本增加
【解析】
(1) LaNi3(s)+3H2(g)![]() LaNi3H6(s) H<0。
LaNi3H6(s) H<0。
①该反应是一个气体分子数减小的反应,在恒容密闭容器中进行该反应,充入氢气,相当于增大压强,平衡正向移动,氢气的转化率将增大;
②由图可知,平衡时,体系压强由9kPa变为3kPa,氢气的物质的量变为起始值的三分之一;
③保持温度不变,容积压缩至原容积的一半,平衡正向移动,气体分子数减小,压强应小于起始压强的2倍;
(2)第三个反应出现CH3OH(g),但目标方程式未出现CH3OH(g),可得出第三个方程式用不到,根据观察发现,②-①可以得到![]() ,
,![]() 用盖斯定律计算即可;
用盖斯定律计算即可;
(3)![]() 是一个气体体积不变的反应,故气体总物质的量=2mol+2mol=4mol,0-5分钟,CO含量减小了0.4,即减小了4×0.4mol=1.6mol,结合体积可计算浓度变化量,进而计算CO表示的速率,进而计算v[H2O(g)]。6分钟到9分钟,CO的含量下降,说明平衡正向移动,且6到9分钟CO含量减少程度比2到5分钟小,说明6分钟改变的条件使反应速率减小了;
是一个气体体积不变的反应,故气体总物质的量=2mol+2mol=4mol,0-5分钟,CO含量减小了0.4,即减小了4×0.4mol=1.6mol,结合体积可计算浓度变化量,进而计算CO表示的速率,进而计算v[H2O(g)]。6分钟到9分钟,CO的含量下降,说明平衡正向移动,且6到9分钟CO含量减少程度比2到5分钟小,说明6分钟改变的条件使反应速率减小了;
(4)①分析图发现,低温时,无论压强多大,CO的转化率都相等;
②实际化工生产除了需要考虑平衡原理外,还要考虑实际生产效率、成本投入等。
(1)①恒温恒容下,增大氢气的起始量,压强增大,平衡正向移动,氢气的转化率增大,结合图像可知:n1<n2<n3,故答案为:n1<n2<n3;
②该反应中只有氢气一种气体,则容器压强与氢气的物质的量成正比,温度T1时,起始时,压强为9kPa,平衡时,压强为3kPa,设平衡时氢气的物质的量为n,则![]() ,解得:n=
,解得:n=![]() ,则平衡时,c(H2)=
,则平衡时,c(H2)=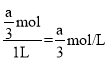 ,所以,K=
,所以,K= =
=![]() ,故答案为:
,故答案为:![]() ;
;
③假设平衡不移动,则t6时刻将容积压缩至原容积的一半,压强应变为t6时刻压强的2倍,即6kPa,但实际情况是,平衡正向移动,气体分子数减小,所以,此时容器内的压强小于6kPa,故答案为:小于;
(2)②-①得:![]() =(-41kJ·mol-1)-(+165kJ·mol-1)=-206 kJ·mol-1,故答案为:-206 kJ·mol-1;
=(-41kJ·mol-1)-(+165kJ·mol-1)=-206 kJ·mol-1,故答案为:-206 kJ·mol-1;
(3)![]() 是一个气体分子总数不变的反应,故气体总物质的量=2mol+2mol=4mol,0-5分钟,CO含量减小了0.4,即减小了4×0.4mol=1.6mol,则CO浓度减小了
是一个气体分子总数不变的反应,故气体总物质的量=2mol+2mol=4mol,0-5分钟,CO含量减小了0.4,即减小了4×0.4mol=1.6mol,则CO浓度减小了![]() =0.16mol/L,v(CO)=
=0.16mol/L,v(CO)=![]() =0.032mol/L,由方程式计量数可知v[H2O(g)]=v(CO)= 0.032mol/L。由分析可知,6分钟时改变的条件使平衡正向移动、同时反应速率减小,又从表格可知,6分钟时CO含量没有变化,不可能是移走生成物,综上所述,6分钟时,降低了温度,故答案为:0.032mol/L;降低温度;
=0.032mol/L,由方程式计量数可知v[H2O(g)]=v(CO)= 0.032mol/L。由分析可知,6分钟时改变的条件使平衡正向移动、同时反应速率减小,又从表格可知,6分钟时CO含量没有变化,不可能是移走生成物,综上所述,6分钟时,降低了温度,故答案为:0.032mol/L;降低温度;
(4)①由图可知,低温时,无论压强多大,CO的转化率几乎相等,则低温时,对CO转化率影响的主要因素是温度,故答案为:温度;
②温度太低,反应速率太慢,不利于甲醇的合成,压强太大,设备抗压要求增大,设备成本增加,故实际生产往往采用300~400 °C和10 MPa的条件,故答案为:温度太低,反应速率太慢,不利于甲醇的合成,压强太大,设备要求提高,成本增加。


科目:高中化学 来源: 题型:
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氨,工作示意图如图所示。通过控制开关连接K1和K2,可交替得到H2和O2,下列有关说法错误的是( )

A.制H2时,开关应连接K1,产生H2的电极反应式是2H2O+2e-=H2↑+2OH-
B.当开关连接K2时,电极3的反应式为Ni(OH)2-e-+OH-=NiOOH+H2O
C.当开关连接K2时,电极2作阳极,得到O2
D.电极3的作用是分别作阳极材料和阴极材料,利用NiOOH和Ni(OH)2的相互转化提供电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依据名称写出物质:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有机物降冰片二烯的分子结构可表示为:
①降冰片二烯的分子式为 ______________;②降冰片二烯属于 __________;
a.环烃 b.不饱和烃 c.烷烃 d.烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为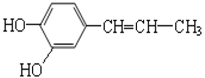 ,请回答问题:
,请回答问题:
(1)此物质是否属于烃?_______(填“是”或者“否”);
(2)此物质的分子式是__________;
(3)此物质中苯环的结构特点________________;
(4)请写出此物质可能具有的一种化学性质________________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家采用碳基电极材料设计了一种制取氯气的新工艺方案,装置如图所示:下列说法错误的是( )
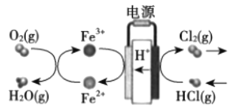
A.反应过程中需要不断补充Fe2+
B.阳极反应式是2HCl- 2e- =Cl2+2H+
C.电路中转移1 mol电子,消耗标况下氧气5.6 L
D.电解总反应可看作是4HCl(g)+O2(g)=2Cl2(g) + 2H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲烷、乙烯、苯三种有机物中具有下列性质的是
①在催化剂作用下能与纯溴反应,不能使酸性高锰酸钾溶液褪色的是_____________;
②见光能跟氯气反应,不能使酸性高锰酸钾溶液褪色的是_____________;
③在催化剂作用下加氢生成乙烷,加水生成酒精的是_____________。
(2)如图是两种有机物的球棍模型,○代表H原子,●代表C原子,请回答下列问题:
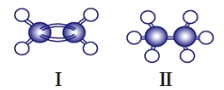
①写出Ⅰ、Ⅱ的化学式_____________、_____________
②说出Ⅰ、Ⅱ在结构上的两点差异_____________,_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池,其工作原理如图所示。

已知C1极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+,下列有关说法不正确的是( )
A. C1极为电池负极,C2极为电池正极
B. 电子由C2极经外电路导线流向C1极
C. C2极的电极反应式为O2+4H++4e-=2H2O
D. 该生物燃料电池的总反应式为:C2H5OH+3O2=2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,能说明反应X2(g)+Y2(g)![]() 2XY(g)已达到平衡的是
2XY(g)已达到平衡的是
A. 容器内的总压不随时间变化B. 容器中气体的平均相对分子质量不随时间变化
C. XY气体的物质的量分数不变D. X2和Y2的消耗速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂(Li)—空气电池的工作原理如图所示下列说法不正确的是

A. 金属锂作负极,发生氧化反应
B. Li+通过有机电解质向水溶液处移动
C. 正极的电极反应:O2+4e—==2O2—
D. 电池总反应:4Li+O2+2H2O==4LiOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com