
| A. | 提高硫酸亚铁的溶解度 | B. | 防止硫酸亚铁分解 | ||
| C. | 抑制硫酸亚铁水解 | D. | 稀硫酸防止硫酸亚铁被氧化 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
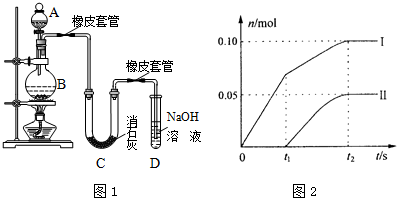
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时不能发生的过程都是非自发过程 | |
| B. | 体系的无序性越高,即混乱度越高,熵值就越大 | |
| C. | 所有自发进行的化学反应都是放热反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
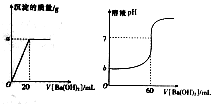 室温下,某同学为测量硫酸和盐酸混合溶液中溶质的浓度进行如下实验:取混合酸20mL放入锥形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,实验记录如下:(1g3=0.5)
室温下,某同学为测量硫酸和盐酸混合溶液中溶质的浓度进行如下实验:取混合酸20mL放入锥形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,实验记录如下:(1g3=0.5)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则可知C的标准燃烧热为110.5 kJ•mol-1 | |
| B. | 在101KPa下氢气的标准燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 稀硫酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(g)=FeS(s)△H=-95.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +CaCl2+H2O,该反应的原子利用率25.4%.
+CaCl2+H2O,该反应的原子利用率25.4%. ,
, )与乙二醇作用,可生成一系列化合物:
)与乙二醇作用,可生成一系列化合物: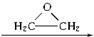 HO-CH2-CH2-O-CH2-CH2-OH
HO-CH2-CH2-O-CH2-CH2-OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com