
| A. | 乙炔和苯 | B. | 一氧化碳和氢气 | C. | 乙炔和乙烯 | D. | 苯和乙烯 |
分析 根据无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成CO2的质量也一定,则说明混合物各组分分子中含碳量一定相等,对应若都是由烃组成混合物,则最简式相同,据此分析解答.
解答 解:A.乙炔和苯的最简式都是CH,二者分子中的含碳量相同,则无论二者不论以任何比例混合,只要当混合物的质量一定时,混合物完全燃烧后生成的二氧化碳的量不变,故A正确;
B.CO和氢气的混合物中,CO的含量不同,生成二氧化碳的量不同,故B错误;
C.乙炔的最简式为CH,乙烯的最简式为CH2,二者最简式不同,则含碳量不同,当二者质量一定、比例不同时生成二氧化碳的量不同,故C错误;
D.苯的最简式为CH,乙烯的最简式为CH2,二者最简式不同,则含碳量不同,当二者质量一定、比例不同时生成二氧化碳的量不同,故D错误;
故选A.
点评 本题考查有机物燃烧的计算,题目难度不大,注意只要总质量一定,完全燃烧时生成CO2的质量也一定,则说明混合物各组分分子中含碳量相等,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
 、
、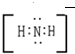 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
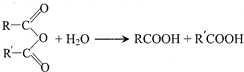
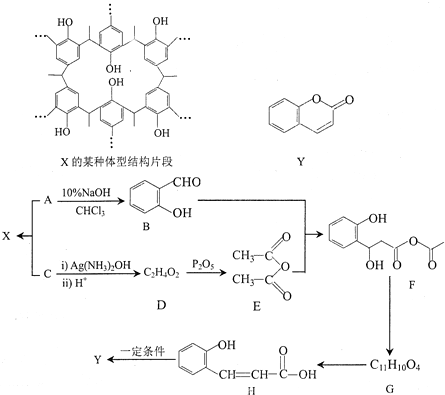
 中的官能团名称为醛基、羟基
中的官能团名称为醛基、羟基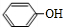 ,DCH3COOH,G
,DCH3COOH,G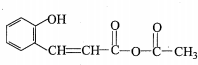

 )氮原子上的氢原子可以像A上的氢原子一样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
)氮原子上的氢原子可以像A上的氢原子一样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式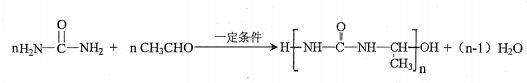
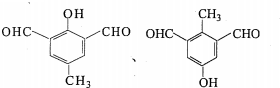 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程的离子方程式:2Cu2++3SO32-→Cu2O↓+SO42-+2SO2↑ | |
| B. | 反应过程的离子方程式:2Cu2++3SO32-+2H2O→Cu2O↓+SO42-+4H+ | |
| C. | 加入过量Na2SO3有利于控制溶液的pH | |
| D. | 在酸性条件下,若有14.4g Cu2O变质,转移电子0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
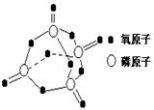 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 434 | B. | 335 | C. | 237 | D. | 188 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把浑浊的液体倒入蒸发皿中加热 | |
| B. | 开始析出晶体后用玻璃棒搅拌 | |
| C. | 待水分完全蒸干后停止加热 | |
| D. | 蒸干水分后用玻璃棒转移固体至滤纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3与Al(OH)3都能够作为治疗胃酸过多的药品 | |
| B. | 可以用铝制器皿盛放浓硫酸和浓氢氧化钠溶液 | |
| C. | 医院里用高锰酸钾溶液和双氧水来消毒,是因为两者有某种共同的性质 | |
| D. | 在水中投入适量的氢氧化钠固体可以增大明矾的净水效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
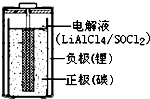 亚硫酰氯(SOCl2)是一种液态的共价化合物,沸点78.8℃,熔点-105℃
亚硫酰氯(SOCl2)是一种液态的共价化合物,沸点78.8℃,熔点-105℃查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com