
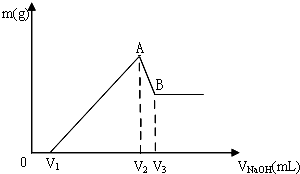
分析 镁铝的混合物溶于盐酸溶液中,发生反应生成氯化镁和氯化铝,先反应后的溶液中滴入氢氧化钠溶液,在氢氧化钠体积小于V1时,氢氧化钠与没有反应的盐酸反应,故0~V1mL时,不产生沉淀,氢氧化钠体积为V1mL~V2mL,氯化镁和氯化铝与开始氢氧化钠反应生成氢氧化镁和氢氧化铝,在A点时沉淀达到最大量;氢氧化钠体积为V2mL~V3mL氢氧化铝和氢氧化钠反应,生成偏铝酸钠,当氢氧化钠体积为V2mL,镁离子和铝离子恰好沉淀,溶液中阳离子为Na+,阴离子为Cl-,即溶液中的溶质为NaCl,n(Na+)=n(Cl-),其中Na+来自NaOH,Cl-来自HCl,故当氢氧化钠体积为V2mL,n(NaOH)=n(HCl),据此解答(1)(2);
(3)若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL3mol•L-1盐酸溶解后,再加入360mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=300ml,再加入60mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,求得:Al(OH)3最大取值0.06mol,即0<n(Al)≤0.06mol,n(Mg)+n(Al)=0.1mol,据此判断镁的物质的量范围及a的范围.
解答 解:镁铝的混合物溶于盐酸溶液中,发生反应生成氯化镁和氯化铝,先反应后的溶液中滴入氢氧化钠溶液,在氢氧化钠体积小于V1时,氢氧化钠与没有反应的盐酸反应,故0~V1mL时,不产生沉淀,氢氧化钠体积为V1mL~V2mL,氯化镁和氯化铝与开始氢氧化钠反应生成氢氧化镁和氢氧化铝,在A点时沉淀达到最大量;氢氧化钠体积为V2mL~V3mL氢氧化铝和氢氧化钠反应,生成偏铝酸钠,当氢氧化钠体积为V2mL,镁离子和铝离子恰好沉淀,溶液中阳离子为Na+,阴离子为Cl-,即溶液中的溶质为NaCl,n(Na+)=n(Cl-),其中Na+来自NaOH,Cl-来自HCl,
(1)根据分析可知,A点的沉淀为:Mg(OH)2、Al(OH)3,镁和流程的物质的量为0.1mol,根据质量守恒定律,则A点生成沉淀的物质的量为0.1mol,
故答案为:0.1mol;
(2)加入V2mLNaOH时,n(NaOH)=n(HCl)=3mol•L-1×0.1L=0.3mol,V(NaOH)=$\frac{0.3mol}{1mol/L}$=0.3L=300mL,
故答案为:300mL;
(3)若混合物仍为0.1mol,其中镁的物质的量分数为a,则镁的物质的量为0.1amol,
用100mL 3mol/LHCl溶液溶解此混合物后,再加入360mL 1mol/L的NaOH溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:V2=300mL,再加入60mL 1mol•L-1氢氧化钠溶液,
所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3最大取值0.06mol,即0<n(Al)≤0.06mol,n(Mg)+n(Al)=0.1mol,则0.04mol≤n(Mg)<0.1mol,
则a的范围为:0.4≤a<1,
故答案为:0.4≤a<1.
点评 本题以图象题的形式考查镁铝单质及其化合物性质、混合物反应的计算,题目难度中等,分析图象各阶段的发生的反应是解题关键,注意掌握常见金属及其化合物性质,明确混合物计算的常用方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
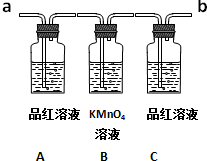 已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2
已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4用如图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | 固体的NaCl不导电,熔融态的NaCl可以导电 | |
| C. | 根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 | |
| D. | “血液透析”原理与胶体的性质无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有吸附性 | |
| B. | 溶解度大于CuS、PbS、CdS | |
| C. | 溶解度小于CuS、PbS、CdS | |
| D. | MnO2的氧化性强于Cu2+、Pb2+、Cd2+等金属离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5L | B. | 5L | C. | 11.2L | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态 | |
| B. | 增大容器的体积,化学平衡不移动,反应速率也不变 | |
| C. | 升高温度使c(B)增大,可知正反应为放热反应 | |
| D. | 加入催化剂,改变了反应历程,但反应的△H不会变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com