
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
|
| A. | 1:4 | B. | 1:2 | C. | 2:1 | D. | 4:1 |
| 氧化还原反应的计算. | |
| 专题: | 氧化还原反应专题. |
| 分析: | 先根据氧化还原反应中得失电子相等配平方程式,再根据化合价变化的和化合价不变的氮原子判断. |
| 解答: | 解:该反应中,NH4+→N2氮元素的化合价由﹣3价→0价,生成一个氮气分子需要铵根离子失去6个电子,生成一个二氧化硫分子需要硫酸根离子得到2个电子,所以其最小公倍数是6,然后其它元素根据原子守恒进行配平方程式,所以该方程式为3(NH4)2SO4 故选B. |
| 点评: | 本题考查了根据方程式进行有关计算,难度不大,注意该方程式中氧化剂和还原剂是同一种物质,但氧化产物和还原产物不同,所以从生成物进行配平较简便. |


科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.完全由非金属组成的化合物不一定是共价化合物
B.构成分子晶体的粒子一定含有共价键
C.分子晶体的熔点一定比金属晶体的熔点低
D.含有金属离子的晶体一定是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.01 mol·L-1 H2SO4溶液中,水电离出的H+浓度为( )
A.1×10-12 mol·L-1 B.1×10-7 mol·L-1
C.5×10-13 mol·L-1 D.5×10-12 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:A(g) 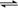 B(g),其反应过程中能量变化如下图所示,下列说法错误的是
B(g),其反应过程中能量变化如下图所示,下列说法错误的是
(以Ea表示活化能,Ea(正)、Ea(逆)分别表示正、逆反应活化能)
A.该反应的 ΔH = Ea(正) - Ea(逆)
B.该反应的Ea(正) = E3 - E2
C.只要温度升高,该可逆反应就会向逆反应方向进行
D.可逆反应B(g) 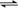 A(g)的ΔH = E2 - E1
A(g)的ΔH = E2 - E1
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中所示物质或概念间的从属关系符合如图的是
|
| X | Y | Z |
| A | 钠元素 | 主族元素 | 短周期元素 |
| B | 电解质 | 化合物 | 纯净物 |
| C | 氢氧化铁 | 胶体 | 分散系 |
| D | 置换反应 | 氧化还原反应 | 放热反应 |

|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:3NF3+5H2O=2NO+HNO3+9HF.下列有关该反应的说法正确的是( )
|
| A. | NF3是氧化剂,H2O是还原剂 |
|
| B. | NF3在潮湿空气中泄漏会看到红棕色气体 |
|
| C. | 每消耗0.2mol氧化剂,可收集到5.418L气体 |
|
| D. | 若生成1molHNO3,则转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
向100mL的FeBr2溶液中通入标准状况下Cl25.04L,Cl2全部被还原,测得溶液中c(Br﹣)=c(Cl﹣),则原FeBr2溶液的物质的量浓度是( )
|
| A. | 0.75mol/L | B. | 1.5mol/L | C. | 2mol/L | D. | 3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于聚乙炔的叙述中错误的是( )
A.聚乙炔是高分子化合物
B.聚乙炔是加聚反应的产物
C.聚乙炔在空气中很稳定、难溶解
D.聚乙炔的结构简式是CH===CH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com