
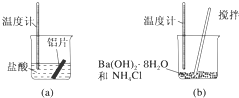
 (1)某同学做如下实验,以检验反应中的能量变化.
(1)某同学做如下实验,以检验反应中的能量变化.分析 (1)探究化学反应中的能量变化时,温度升高,则反应放热;温度降低则反应吸热;吸热反应反应物总能量低于生成物,据此分析;
(2)能设计成原电池的反应必须是自发进行的放热的氧化还原反应,据此分析解答.
解答 解:(1)通过实验测出,反应前后a烧杯中的温度升高,b烧杯中的温度降低,根据温度升高,反应放热,温度降低,反应吸热,所以Al跟盐酸的反应是放热反应,b是吸热反应,反应物总能量低于生成物,故答案为:放;低于;
(2)①氢氧化钠与硫酸反应,该反应不是氧化还原反应,所以不能设计成原电池,故错误;
②一氧化碳与氧气反应,该反应是放热反应且是自发的氧化还原反应,所以能设计成原电池,故正确;
③八水合氢氧化钡与氯化铵反应,该反应是吸热反应,所以不能设计成原电池,故错误;
④金属铜与硝酸银反应,该反应是放热反应且是自发的氧化还原反应,所以能设计成原电池,故正确,
故答案为:②④.
点评 本题考查学生根据实验现象判断放热与吸热反应、原电池原理,注意放热反应反应物总能量高于生成物,断键吸收能量少于成键放出能量,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 增加体系的压强 | B. | 减少C的物质的量浓度 | ||
| C. | 增加A的物质的量 | D. | 升高体系的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
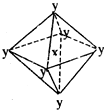 在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图).该晶体可能为( )
在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图).该晶体可能为( )| A. | NaCl | B. | CsCl | C. | CO2 | D. | SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯是强氧化剂 | B. | 二氧化氯是强还原剂 | ||
| C. | 二氧化氯是离子化合物 | D. | 二氧化氯分子中氯为-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
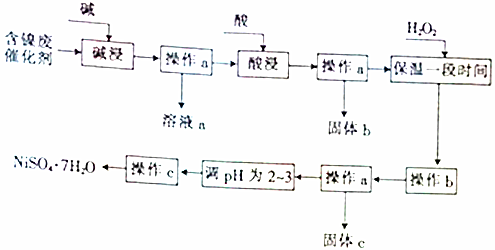
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,X是一种能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,写出上述过程对应的化学方程式2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓.某研究性小组同学开动脑筋,为确定干燥的X 和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体.你认为此方案正确 (填正确,不正确),理由是SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟.
.该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,X是一种能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,写出上述过程对应的化学方程式2S2Cl2+2H2O=SO2↑+4HCl↑+3S↓.某研究性小组同学开动脑筋,为确定干燥的X 和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体.你认为此方案正确 (填正确,不正确),理由是SO2与干燥的NH3不反应,而HCl和干燥的NH3反应生成白烟.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是用于衡量化学反应进行快慢的物理量 | |
| B. | 决定化学反应速率的主要因素是反应物本身的性质 | |
| C. | 可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零 | |
| D. | 增大反应物浓度或升高反应温度都能加快化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com