
【题目】下列物质分类正确的是( )
A.SO2、SiO2、CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.盐酸、水玻璃、氨水均为混合物
D.烧碱、冰醋酸、四氯化碳均为电解质
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层电子结构都符合相应稀有气体原子的最外层电子结构,则下列有关说法中不正确的是 ( )
A.NH5中既有离子键又有共价键
B.NH5的熔沸点高于NH3
C.1 mol NH5中含有5 mol N—H键
D.将固体A投入少量水中,可生成H2和NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断错误的是 ( )

A. NaOH的浓度为0.6 mol·L-1 B. 在a点处溶液中的溶质为NaCl
C. 混合溶液中n(Al3+)﹕n(Mg2+)=1﹕1 D. 图中线段oa : ab=4﹕1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8g Cr2O72-转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-==Fe2+,阴极反应式是2H++2e-==H2↑。

(1)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因_________________。
(4)若溶液中初始含有0.1mol Cr2O72-,则生成的阳离子全部转化化成沉淀的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g) (正反应放热)达到平衡后,将气体混合物的温度降低,下列叙述正确的是
2C(g) (正反应放热)达到平衡后,将气体混合物的温度降低,下列叙述正确的是
A. 正反应速率增大,逆反应速率变小,平衡向正反应方向移动
B. 正反应速率变小,逆反应速率增大,平衡向逆反应方向移动
C. 正反应速率和逆反应速率都变小,平衡向正反应方向移动
D. 正反应速率和逆反应速率都变小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如下:
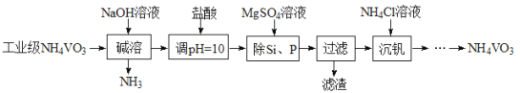
(1)碱溶时,下列措施有利于NH3逸出的是_____(填字母)。
A.升高温度 B.增大压吸 C.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×l0-5.若滤液中c(SiO32-)=0.08mol/L,则c(Mg2+)=__________。
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和_______;但随着温度的升高,除硅率升高,其原因是______(用离子方程式表示)。

(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为_______。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入_______mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率。加入蒸馏水的目的是______。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池和电解池的比较中正确的是( )
A.能量转化形式相同
B.两极的名称相同
C.负极和阴极上移向的离子类别相同
D.负极和阳极上发生的反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列转化中,碳原子间的连接形式未发生改变的是
A. 丁酮的催化加氢反应 B. 丙酮与HCN发生加成反应
C. 乙醛与乙醛反应生成2—羟基丁醛 D. 乙苯与酸性高锰酸钾溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氢氧化钠(NaOH)和过氧化钠(Na202)组成混合物中检测出氢元素的质量分数为2.5%,那么混合物中钠元素的质量分数为
A. 46% B. 57.5% C. 58.4% D. 无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com