



 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源:不详 题型:单选题
| A.ⅠA族元素的金属性一定比ⅡA族元素的金属性强 |
| B.族序数等于其周期序数的元素一定是金属元素 |
| C.全部由非金属元素组成的化合物中只含共价键 |
| D.13C和14C互为同位素,化学性质相似 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
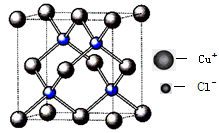
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


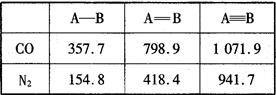
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 4FeCl2+N2O↑+6HCl+H2O
4FeCl2+N2O↑+6HCl+H2O

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配位体是Cl-和H2O,配位数是9 |
| B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ |
| C.内界和外界中的Cl-的数目比是1:2 |
| D.加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com