
【题目】某化学兴趣小组为了探究“干燥的CO2不能与Na2O2反应”而“潮湿的CO2能与Na2O2反应”,设计了如下装置进行实验(夹持仪器已省略)。
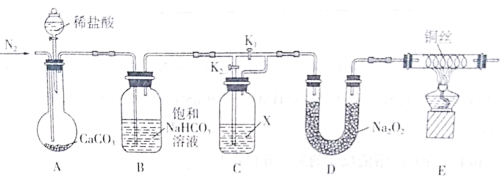
回答下列问题:
(1)实验开始前先通入一段时间的N2,目的是________。
(2)饱和NaHCO3溶液的作用是_________;试剂X是___________。
(3)实验时,首先打开装置A中分液漏斗的活塞,加入稀盐酸;然后关闭K1,打开K2,实验中观察到E中灼热的铜丝颜色未发生变化,则得出的结论是_______。
(4)若_____(填操作),E中灼热的铜丝变为黑色,可证明潮湿的CO2能与Na2O2反应。
(5)写出D中CO2与Na2O2反应的化学方程式___________。
【答案】排除装置中的空气 除去CO2气体中的HCl气体 浓硫酸 干燥的CO2不能与Na2O2反应 打开K1,关闭K2 2CO2+2Na2O2=2Na2CO3+O2
【解析】
为了探究“干燥的CO2不能与Na2O2反应”而“潮湿的CO2能与Na2O2反应”,设计了如下装置进行实验,先用氮气排尽装置A中的空气,利用装置A制取CO2,通过装置B利用饱和碳酸氢钠溶液除去氯化氢气体,再通过装置C,装有浓硫酸,若打开K2关闭K1则为干燥的CO2,若打开K1关闭K2则为潮湿的CO2,经过装置D与过氧化钠作用,再通过装置E用灼热的铜丝检验是否有氧气生成,据此分析。
(1)后续实验要验证是否有氧气生成,故实验开始前先通入一段时间的N2,目的是排除装置中的空气;
(2)盐酸易挥发,制得的二氧化碳中含有氯化氢气体,饱和NaHCO3溶液的作用是除去CO2气体中的HCl气体;试剂X是起干燥剂作用,可选用浓硫酸;
(3)实验时,首先打开装置A中分液漏斗的活塞,加入稀盐酸;然后关闭K1,打开K2,则气体被干燥,为干燥的CO2,实验中观察到E中灼热的铜丝颜色未发生变化,则D中没有氧气生成,则得出的结论是干燥的CO2不能与Na2O2反应;
(4)若打开K1,关闭K2 ,则二氧化碳末被干燥,E中灼热的铜丝变为黑色,可证明潮湿的CO2能与Na2O2反应;
(5)D中CO2与Na2O2反应生成碳酸钠和氧气,反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.芳香烃是分子组成符合CnH2n-6(n≥6)的一类物质
B.苯和浓硝酸在55~60℃,浓硫酸存在时发生硝化反应
C.甲苯可以和浓硝酸与浓硫酸的混合物发生硝化反应
D.等质量的烃(CxHy)耗氧量取决于![]() 的值,越大则耗氧多
的值,越大则耗氧多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为日常生活中最常见的液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质之间的转化关系如图所示。下列说法正确的是
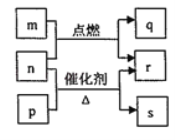
A.m与r中所含化学键类型相同
B.r的沸点高于p的沸点
C.m与q混合没有明显现象
D.q与s均为酸性氧化物,m的水溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题。
(1)焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了________而变为激发态。
(2)新型农药松脂酸铜具有低残留的特点,图是松脂酸铜的结构简式。请分析
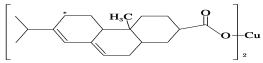
1个松脂酸铜中π键的个数为________;加“*”碳原子的杂化方式为________。
(3)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型为________,比较第一电离能:S________O(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液仅含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的4种离子,所含离子的物质的量均为
中的4种离子,所含离子的物质的量均为![]() 。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法错误的是( )
。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法错误的是( )
A.该溶液中所含的离子是:![]() 、
、![]() 、
、![]() 、
、![]()
B.若向该溶液中加入过量的稀硫酸和![]() 溶液,溶液显血红色
溶液,溶液显血红色
C.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
D.若向该溶液中加入足量的![]() 溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为
溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。裂解的副反应为C4H10(g,正丁烷)![]() CH4(g)+C3H6(g),请回答下列问题:
CH4(g)+C3H6(g),请回答下列问题:
(1)化学上,将稳定单质的能量定为0,由元素的单质化合成单一化合物时的反应热叫该化合物的生成热,生成热可表示该物质相对能量。25 ℃、101 kPa几种有机物的生成热如下表所示:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ· mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
由正丁烷裂解生成乙烯的热化学方程式为_____________________________。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
下列情况能说明该反应达到平衡状态的是________(填标号)。
A.气体密度保持不变 B.c(C2H4)·c(C2H6)/c(C4H10)保持不变
C.反应热保持不变 D.正丁烷分解速率和乙烷消耗速率相等
(3)向密闭容器中充入正丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是____________。
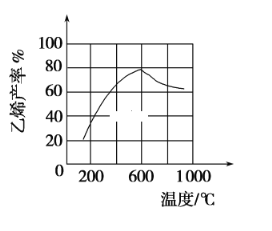
(4)在一定温度下向10 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)=________ mol·L-1·min-1。
②上述条件下,正丁烷的平衡转化率为_______,该反应的平衡常数K为_____。
(5)丁烷空气燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e-===26CO32-,则负极反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精制氯化钾在工业上可用于制备各种含钾的化合物,完成下列填空,工业氯化钾中含有![]() 、
、![]() 、
、![]() 等杂质离子,可按如下步骤进行精制,完成各步内容:
等杂质离子,可按如下步骤进行精制,完成各步内容:
①溶解;②加入试剂至![]() 、
、![]() 沉淀完全,煮沸;③____________;④加入盐酸调节
沉淀完全,煮沸;③____________;④加入盐酸调节![]() ;⑤____________(除
;⑤____________(除![]() );⑥蒸干灼烧。步骤②中,依次加入的沉淀剂是
);⑥蒸干灼烧。步骤②中,依次加入的沉淀剂是![]() 、______、______。证明
、______、______。证明![]() 已沉淀完全的操作是____________。
已沉淀完全的操作是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是( )
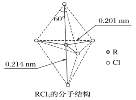
A. 每个原子都达到8电子稳定结构
B. 分子中5个R—Cl键键能不相同
C. 键角(Cl—R—Cl)有90°、120°、180°几种
D. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.25mol某固体A的质量是15g,A的相对分子质量为______.
(2)在同温同压同体积的条件下,H2与气体A的质量之比是1:8,则A的摩尔质量为______.
(3)在同温同压下,相同体积的CH4与气体A的密度之比为1:4,则A的摩尔质量为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com