
【题目】把煤作为燃料可通过下列两种途径获得热量:
途径Ⅰ:C(s)+O2(g)═CO2(g) △H1<0 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g) △H3<0 ③
2H2(g)+O2(g)═2H2O(g) △H4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上____(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)途径Ⅱ在制水煤气的反应里,反应物所具有的总能量____生成物所具有的总能量(填“大于”、“等于”或“小于”),因此在反应时,反应物就需要___能量才能转化为生成物。
(3)途径I中通常将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是______
①使煤充分燃烧,提高能量的转化率 ②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
(4)△H1、△H2、△H3、△H4的数学关系式是____________________
【答案】等于 小于 吸收 ①②③ △H1=△H2 +![]() (△H3+△H4)
(△H3+△H4)
【解析】
(1)根据盖斯定律,反应热只与始态与终态有关,与途径无关,始态相同、终态相同反应热相同;
(2)途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g) △H2>0,反应吸热,所以反应物所具有的总能量小于生成物所具有的总能量,故填小于;
(3)将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是使煤充分燃烧,提高能量的转化率;减少SO2的产生,避免造成“酸雨”, 减少有毒的CO产生,避免污染空气,故选①②③;
(4)C(s)+H2O(g)═CO(g)+H2(g);△H2>0 ②
2CO(g)+O2(g)═2CO2(g);△H3<0 ③
2H2(g)+O2(g)═2H2O(g);△H4<0 ④
根据盖斯定律,②+③×![]() +④×
+④×![]() 得C(s)+O2(g)═CO2(g),故△H1=△H2+
得C(s)+O2(g)═CO2(g),故△H1=△H2+![]() (△H3+△H4)故答案为:△H1=△H2+
(△H3+△H4)故答案为:△H1=△H2+![]() (△H3+△H4)。
(△H3+△H4)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是( )
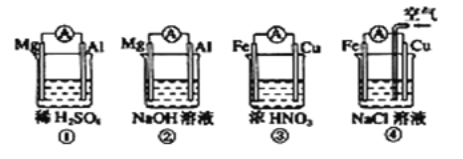
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为2H2O+2e-=2OH-+H2↑
C.③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D.④中Cu作正极,电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁钾矾[KxFey(SO4)m·nH2O]常用作工业媒染剂。其组成可用如下方法测定:
①准确称取2.0120g样品配成100mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.466g。
③准确量取25.00mL溶液A,加入足量的KI溶液,以淀粉为指示剂,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至终点(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
(1)要检验出A溶液中存在的Fe3+,可以加入____________溶液。
(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 molL-1,应保持溶液中c(Ba2+)≥__________mol·L-1。
(3)步骤③中判断滴定终点的方法是_____________________。
(4)通过计算确定铁钾矾的组成(写出计算过程)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
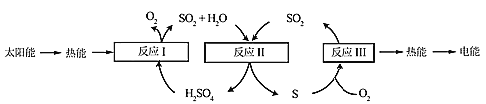
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示:
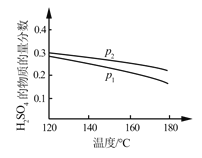
p2_______p 1(填“>”或“<”)。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+_________=_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到 2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示。则b电极上的电极反应式为__________________。
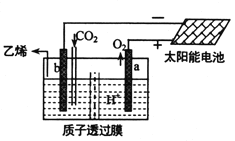
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同条件下,0.1mol·L-1Na2S2O3溶液和0.1mol·L-1H2SO4溶液各5mL,与10mL水混合,反应速率为υ1mol·L-1·s-1;0.2mol·L-1Na2S2O3溶液和0.2mol·L-1H2SO4溶液各5mL,与30mL水混合,反应速率为υ2mol·L-1·s-1。则υ1和υ2的关系是( )
A.υ1>υ2B.υ1<υ2C.υ1=υ2D.不能肯定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为1 L的密闭容器中,通入一定量的CO和H2O,在850 ℃ 发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。CO和H2O浓度变化如图:
CO2(g)+H2(g) ΔH<0。CO和H2O浓度变化如图:

(1)0~4 min的平均反应速率v(CO)=__________________mol·(L·min)-1。
(2)850 ℃时,平衡常数K=___________________。
(3)850 ℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为___________。
(4)能判断该反应达到化学平衡状态的依据是________(填选项序号)。
a.v正(H2)=v逆(H2O) b.c(CO2)=c(CO)
c.容器中气体密度不变 d.1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2A为二元酸,其酸式盐NaHA的水溶液呈碱性,则下列有关结论错误的是( )
A.H2A为二元弱酸B.NaHA水溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
C.物质的量浓度相同时,碱性:Na2A>NaHAD.H2A在水溶液中电离方程式为:H2A=2H++A2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图甲是高铁电池的实验装置:已知放电后,两极得到铁的相同价态的化合物。
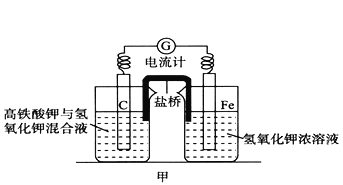
(1)该电池放电时正极发生的电极反应是___________。
(2)若该电池属于二次电池,则充电时阴极反应的电极反应式为___________ 。
(3)已知盐桥中含有饱和KCl溶液,放电时,盐桥的作用是___________。此盐桥中阴离子的运行方向是___________;若用某种高分子材料制成隔膜代替盐桥,该隔膜允许通过的离子是___________。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为___________mol·L1,此时溶液中c(CrO42-)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与实验目的对应的是 ( )
实验操作 | 实验目的 |
A、向淀粉水解液中直接滴加碘水 | 检验淀粉是否完全水解 |
B、C2H4 与SO2 混合气体通过盛有酸性高锰酸钾的洗气瓶 | 除去 C2H4 中的SO2 |
C、 将电石和饱和氯化钠溶液反应生成的气体通入饱和硫酸铜溶液中 | 验证生成的是乙炔气体 |
D、将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com