
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +485 kJ•mol-1 | B. | -485 kJ•mol-1 | C. | +1940 kJ•mol-1 | D. | -1940 kJ•mol-1 |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+和Al(OH)3 | B. | Al(OH)3 | C. | AlO2-和Al(OH)3 | D. | AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
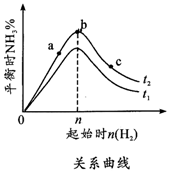 (1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H<0反应的影响可表示成如图所示的规律(图中t表示温度,n表示物质的量).
(1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) $?_{△}^{催化剂}$2NH3(g)△H<0反应的影响可表示成如图所示的规律(图中t表示温度,n表示物质的量).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 原NH4HCO3溶液中:c(OH-)=c(H+)-c(CO32-)-c(NH3•H2O)+c(H2CO3) | |
| C. | 析出晶体后的溶液中:c(Cl-)=c(NH4+),c(Na+)=c(HCO3-) | |
| D. | 析出晶体后的溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对燃煤进行脱硫,减少向大气排放SO2 | |
| B. | 对含SO2、NO2等工业废气进行无害处理后,再排放到大气中 | |
| C. | 为增加工业产值,大力兴建水泥厂、炼钢厂 | |
| D. | 对汽车等交通工具采用清洁燃料,如天然气、甲醇等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
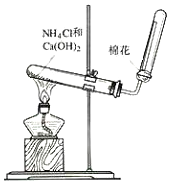
| A. | 收集方法是向下排空气法 | |
| B. | 将湿润的蓝色石蕊试纸放在试管口处验满 | |
| C. | 试管口的棉花可防止氨气与空气形成对流,利于收集氨气 | |
| D. | 实验结束后将蘸有稀硫酸的棉花放在导管口吸收剩余氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
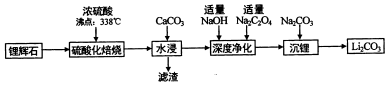
| 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com