
氯化钠为8.700 g,溴化钾为0.500 g,氯化钙为0.800 g。
解析:设混合物中各物质的质量:NaCl为x,KBr为y,CaCl2为z。
x+y+z=10.000 g ①
2KBr+Cl2==2KCl+Br2
混合物中KBr转化为KCl,灼烧后溴全部挥发,因此:
x+![]() y+z=9.813 g ②
y+z=9.813 g ②
①-②得:(1-![]() )y=(10.000-9.813)g
)y=(10.000-9.813)g
解得y=0.500 g。
残留物溶于水后加入足量碳酸钠溶液,发生如下反应:
CaCl2+Na2CO3==CaCO3↓+2NaCl
从所得CaCO3的质量可以算出CaCl2的质量:
z=0.721 g×![]() =0.800 g
=0.800 g
氯化钠的质量为:x=10.000 g-0.500 g-0.800 g=8.700 g。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2013-2014学年江西省新余市高三上学期期末质量检测化学试卷(解析版) 题型:实验题
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
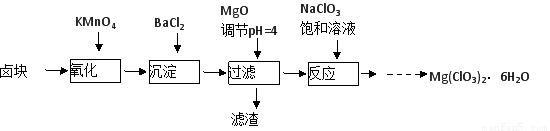
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
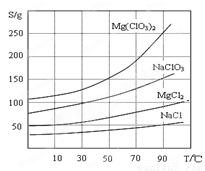
②四种化合物的溶解度(S )随温度(T )变化曲线如图所示。
(1)过滤所需要的主要玻璃仪器有??????????? 。
(2)加入BaCl2的目的是???????? ,加MgO后过滤所得滤渣的主要成分为???????????? 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为?????????????????????????????
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7? 溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7??? 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:???????????????????????????????????????? ;
②产品中Mg(ClO3)2·6H2O的质量分数为?????????? 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省八校高三第一次联考理综化学试卷(解析版) 题型:填空题
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有 ,
(2)加入BaCl2的目的是 ,加MgO后过滤所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①蒸发结晶;② ;③ ;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式: ;
②产品中Mg(ClO3)2·6H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三考前模拟化学试卷(解析版) 题型:实验题
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有 ,加MgO后过滤所得滤渣的主要成分为 。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?答: 。
(3)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:① ;② ;③ ;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1的
FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:
②产品中Mg(ClO3)2·6H2O的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com