
| A. | 20 | B. | 16 | C. | 9 | D. | 25 |
分析 反应①的平衡常数k=c(NH3)•c(HI),NH4I分解生成的HI为平衡时HI与分解的HI之和,即为NH4I分解生成的NH3,由反应②可知分解的c(HI)为平衡时c(H2)的2倍,求出为NH4I分解生成的NH3,代入反应①的平衡常数k=c(NH3)•c(HI)计算.
解答 解:平衡时c(HI)=4mol•L-1,HI分解生成的H2的浓度为0.5mol•L-1.
NH4I分解生成的HI的浓度为4mol•L-1+2×0.5mol•L-1=5mol•L-1,所以NH4I分解生成的NH3的浓度为5mol•L-1,
所以反应①的平衡常数k=c(NH3)•c(HI)=5mol•L-1×4mol•L-1=20mol2•L-2.
故选A.
点评 本题的解题关键在于平衡时HI为NH4I分解生成的HI与分解的HI之差,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 还原性:Br->Fe2+>I- | B. | 还原性:I->Fe2+>Br- | ||
| C. | 氧化性:Br2>I2>Fe3+ | D. | 氧化性:I2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
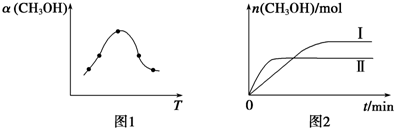
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
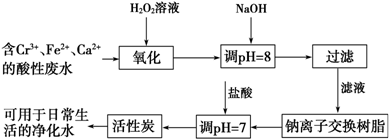
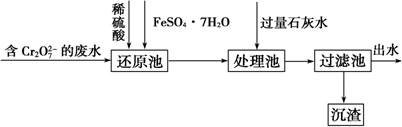
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中含有K+ | |
| B. | 向无色溶液中加入BaCl2溶液有白色沉淀出现,则溶液中含有SO42ˉ | |
| C. | 用一束光照射氯化铁溶液和氢氧化铁胶体,都出现丁达尔现象 | |
| D. | 向某溶液中加入NaOH溶液后再加热,若产生的气体能使湿润红色石蕊试纸变蓝,则该溶液中肯定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n-2 | B. | n | C. | n-1 | D. | 2n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{14m}{n-m}$ | B. | $\frac{14m}{m+2n}$ | C. | $\frac{14m}{2n-m}$ | D. | $\frac{2n-m}{14m}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶、陶瓷、玻璃的主要成分都是硅酸盐 | |
| B. | 合金的熔点通常比組分金属低.硬度比组合分金属高 | |
| C. | 自行车钢架生锈主要是电化学腐蚀所致 | |
| D. | 聚氯乙烯不能做食品包装袋 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com