
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
实狯 | 现象 | ||
| 编号 | 溶液x | |
I | 0.1mol/LFe(NO3)2,pH≈l | 溶液黄色立即加深,30秒后溶液变为褐色,无浑浊 | |
Ⅱ | KNO3和HNO3,其中c(NO3-)=0.3mol/L,pH≈1 | 1小时内溶液颜色始终保持无色 | |
Ⅲ | 0.1mol/LAgNO3 | 迅速变浑浊,离心分离后上层溶液为无色(经检测无I2),固体为黄色(AgI) | |
IV | 0.1mol/LCu(NO3)2 | 5秒后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有I2),固体为白色(CuI) | |
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式___,该条件下氧化性:Fe3+___I2(选填“>”或“<”)。
③实验Ⅱ的目的是___。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+>I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与CuI沉淀有关,故不能确定氧化性:Cu2+>I2,并用如图装置进行验证。K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+___I2(选填“>”或“<”)。
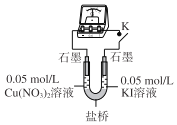
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是___。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
【答案】淀粉溶液或者四氯化碳 2Fe3++2I-2Fe2++I2 作对比实验,排除了实验条件下I2不是NO3-或水中溶解的O2氧化得到 > 2Cu2++4I-=2CuI↓+I2 I2 < 发生2Cu2++2I-2Cu++I2,由于Cu+与I-生成CuI沉淀,使产物浓度降低,平衡移动,促进反应进行
【解析】
(1)①碘单质遇到淀粉变蓝色,有机溶剂也能萃取碘呈现特殊颜色;
②Fe3+与I-反应生成碘单质和亚铁离子,氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;
③作对照实验,排除实验条件下I2不是NO3-或水中溶解的O2氧化得到;
(2)实验IV中,通过实验现象知,Cu2+与I-反应有CuI和碘单质生成,说明二者发生氧化还原反应;
(3)图为具有盐桥的原电池较长时间发现两侧溶液均无明显变化,说明Cu2+不能氧化I-。将左侧电极改为Cu电极,进一步判断Cu2+和I2的氧化性强弱,左侧溶液颜色加深,说明发生转化Cu→Cu2+右侧发生还原反应,即I2![]() I-;
I-;
(4)反应IV发生:2Cu2++2I-=2Cu++I2沉淀促进平衡移动;
(5)反应体系中各物质浓度对氧化还原反应发生都有一定的影响。
(1) ①由“黄色立即加深”初步判断有![]() 生成,选择淀粉溶液或者四氯化碳进一步证实生成了
生成,选择淀粉溶液或者四氯化碳进一步证实生成了![]() ,故答案为:淀粉溶液或者四氯化碳;
,故答案为:淀粉溶液或者四氯化碳;
![]() 与
与![]() 反应生成碘单质和亚铁离子,反应离子方程式为:
反应生成碘单质和亚铁离子,反应离子方程式为:![]() ,故氧化性:
,故氧化性:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
![]() 实验II中没有
实验II中没有![]() 生成,说明实验条件下
生成,说明实验条件下![]() 不是
不是![]() 或水中溶解的
或水中溶解的![]() 氧化得到,排除
氧化得到,排除![]() 或水中溶解的
或水中溶解的![]() 的干扰,故答案为:作对比实验,排除了实验条件下
的干扰,故答案为:作对比实验,排除了实验条件下![]() 不是
不是![]() 或水中溶解的
或水中溶解的![]() 氧化得到;
氧化得到;
(2)实验IV中,通过实验现象知,![]() 与
与![]() 反应有CuI和碘单质生成,说明二者发生氧化还原反应,反应离子方程式为:
反应有CuI和碘单质生成,说明二者发生氧化还原反应,反应离子方程式为: ![]() ,故答案为:
,故答案为: ![]() ;
;
(3)图为具有盐桥的原电池,较长时间发现两侧溶液均无明显变化,说明![]() 不能氧化
不能氧化![]() ,将左侧电极改为Cu电极电极发生偏转,左侧溶液颜色加深,说明发生转化
,将左侧电极改为Cu电极电极发生偏转,左侧溶液颜色加深,说明发生转化![]() ,右侧发生还原反应,向右侧溶液中加入少量
,右侧发生还原反应,向右侧溶液中加入少量![]() ,发生转化
,发生转化![]() ,说明氧化性明该条件下氧化性:
,说明氧化性明该条件下氧化性:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(4)反应IV发生:![]() ,由于
,由于![]() 与
与![]() 生成CuI沉淀,使产物浓度降低,平衡移动,促进反应进行,故答案为:发生
生成CuI沉淀,使产物浓度降低,平衡移动,促进反应进行,故答案为:发生![]() ,由于
,由于![]() 与
与![]() 生成CuI沉淀,使产物浓度降低,平衡移动,促进反应进行;
生成CuI沉淀,使产物浓度降低,平衡移动,促进反应进行;


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组以海水晒盐后的苦囟![]() 含有
含有![]() 为原料,设计制备碘单质
为原料,设计制备碘单质![]() 的转化途径如图,下列说法不正确的是
的转化途径如图,下列说法不正确的是

A.生活中可直接使用![]() 淀粉试纸检验加碘盐中是否含有碘
淀粉试纸检验加碘盐中是否含有碘
B.途径Ⅲ发生反应的离子方程式可能是![]()
C.由图可知氧化性的强弱顺序为![]()
D.两种途径得到等量的碘,消耗氯气物质的量比为1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如下图所示的实验装置(固定装置已略去)。

①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_______(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是___________________;装置D的作用是___________________。
③装置C中发生反应的化学方程式为________________________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_____________________________。
⑤该装置存在的主要缺陷是___________________________________________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图所示装置(其余部分相同)进行实验。

①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是___________,U型管中加入的试剂是___________。
②此装置能产生大量氨气的原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素的名称:A______, B_______, C________,D__________
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式________________,B元素能量最高的电子为_____轨道上的电子,其轨道呈_______形.
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。
(4)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.将5.85gNaCl晶体溶入100mL水中,制得0.1mol/LNaCl溶液
B.将1体积cmol/L硫酸溶液用水稀释为5体积,得到0.2cmol/L硫酸溶液
C.将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L
D.将wga%NaCl溶液蒸发掉![]() g水,一定得到2a%NaCl溶液
g水,一定得到2a%NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH>0能自发进行,其原因是ΔS>0
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
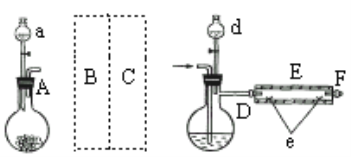
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
请回答:
(1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________,为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽;②是________.
Ⅱ.探究FeBr2的还原性
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:_____________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.Na2CO3溶液呈碱性的原因:CO![]() +H2O=HCO
+H2O=HCO![]() +OH-
+OH-
C.NaHCO3溶液中加足量Ba(OH)2溶液:HCO![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
D.酸性溶液中KIO3与KI反应生成I2:IO![]() +I-+6H+=I2+3H2O
+I-+6H+=I2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、人类生产、社会可持续发展密切相关,下列叙述正确的是
A.塑料、有机玻璃、光导纤维、碳纤维都是新型有机高分子材料
B.磁性氧化铁可用于制备红色颜料和油漆
C.用明矾溶液可清除铜镜表面的铜锈,是因为溶液中的A13+离子能与铜锈反应
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗,该过程涉及胶体性质的应用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com