
【题目】(1)某科学工作者通过![]() 射线衍射分析推测胆矾中既含有配位键,又含有氢键,其结构可能如图所示,其中配位键和氢键均用虚线表示。
射线衍射分析推测胆矾中既含有配位键,又含有氢键,其结构可能如图所示,其中配位键和氢键均用虚线表示。

①写出基态Cu原子的核外电子排布式:__。
②写出图中水合铜离子的结构简式(必须将配位键表示出来):__。
(2)很多不饱和有机物在Ni的催化作用下可以与H2发生加成反应,如①CH2=CH2、②CH![]() CH、③
CH、③![]() 、④HCHO等,其中碳原子采取sp2杂化的分子有__(填序号),推测HCHO分子的立体构型为__形。
、④HCHO等,其中碳原子采取sp2杂化的分子有__(填序号),推测HCHO分子的立体构型为__形。
【答案】1s22s22p63s23p63d104s1或[Ar]3d104s1 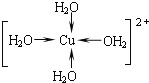 ①③④ 平面三角
①③④ 平面三角
【解析】
(1)①铜是29号元素,其原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式;②CuSO45H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4,据此书写水合铜离子的结构简式;
(2)根据杂化轨道数判断杂化类型,杂化轨道数=σ键数+孤对电子对数;根据杂化轨道方式及杂化轨道成键情况判断HCHO立体结构。
①铜是29号元素,其原子核外有29个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
②CuSO45H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4,水合铜离子的结构简式为 ,故答案为:
,故答案为: ;
;
(2)①CH2=CH2中每个碳原子成2个C-Hσ键,1个碳碳双键,双键中含有1个σ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;②CH≡CH中每个碳原子成1个C-Hσ键,1个碳碳三键,三键中含有1个σ键、2个π键,杂化轨道数为1+1=2,所以碳原子采取sp杂化;③苯中每个碳原子成1个C-Hσ键,2个C-Cσ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化;④HCHO中碳原子成2个C-Hσ键,1个碳氧双键,双键中含有1个σ键、1个π键,杂化轨道数为2+1=3,所以碳原子采取sp2杂化;故①③④采取sp2杂化;HCHO中碳原子采取sp2杂化,杂化轨道为平面正三角形,没有孤对电子对,参与成键的原子不同,所以HCHO为平面三角形,故答案为:①③④;平面三角。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下,下列叙述不正确的是

A. 加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
B. 向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
C. 隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
D. 烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素位于元素周期表中前四周期,原子序数依次增大。A元素的价电子排布为nsnnpn+1;B元素原子最外层电子数是次外层电子数的3倍;C位于B的下一周期,是本周期最活泼的金属元素;D基态原子的3d原子轨道上的电子数是4s原子轨道上的4倍;E元素原子的4p轨道上有3个未成对电子。回答下列问题(用元素符号表示或按要求作答)。
(1)A、B、C的第一电离能由小到大的顺序为____________,三者电负性由大到小的顺序为_________。
(2)A和E的简单气态氢化物沸点高的是______,其原因是_________。
(3)D3+基态核外电子排布式为_________________。
(4)E基态原子的价电子轨道表示式为___________。
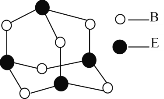
(5)B和E形成分子的结构如图所示,该分子的化学式为_______,E原子的杂化类型为________。
(6)B和C能形成离子化合物R,其晶胞结构如图所示:
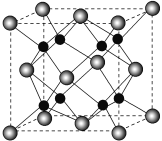
①一个晶胞中含______个B离子。R的化学式为__________。
②晶胞参数为a pm,则晶体R的密度为_____________gcm-3(只列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在极性分子中,正电荷重心与负电荷重心间的距离称为偶极长,通常用![]() 表示。极性分子的极性强弱与偶极长和电荷量(
表示。极性分子的极性强弱与偶极长和电荷量(![]() )有关,一般用偶极矩(
)有关,一般用偶极矩(![]() )来衡量。分子的偶极矩是偶极长和电荷量的乘积,即
)来衡量。分子的偶极矩是偶极长和电荷量的乘积,即![]() 。在非极性分子中,其正、负电荷重心重合,故
。在非极性分子中,其正、负电荷重心重合,故![]() 为0。试回答下列问题:
为0。试回答下列问题:
(1)HCl、CS2、H2S、SO2四种分子中![]() 的有______________________________。
的有______________________________。
(2)实验测得:![]()
①由此可知,PF3分子的空间构型为____________________;
②BCl3分子的空间构型为____________________,中心原子的杂化方式为____________________。
(3)治癌药物![]() 具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的
具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的![]() ,淡黄色化合物的
,淡黄色化合物的![]() 。试写出两种同分异构体的结构简式:____________________(棕黄色)、____________________(淡黄色),在水中溶解度较大的是____________________(填结构简式)。
。试写出两种同分异构体的结构简式:____________________(棕黄色)、____________________(淡黄色),在水中溶解度较大的是____________________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. HClO、H2CO3、HNO3、HClO4的酸性依次增强
B. 苹果酸![]() 含有1个手性碳原子
含有1个手性碳原子
C. HCl、NH3、C2H5OH均易溶于水的原因之一是与H2O分子均形成氢键
D. 以极性键结合的分子不一定是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的叙述不正确的是( )
A.氯化钠和氯化铯晶体中,阴离子的配位数均为6
B.金刚石为空间网状结构,由碳原子以sp3杂化轨道形成共价键
C.金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活及科学研究方面应用非常广泛。
(1)铜元素基态原子的电子排布式为________,铜晶体中的原子堆积模型属于______(填堆积模型名称)。
(2)金属铜的导电性仅次于银,大量用于电气工业。请解释金属铜能导电的原因:______。
(3)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4的熔点更高的原因是______。
(4)如图所示是铜与金的一种合金晶体的立方晶胞。

①该晶体中,Cu与Au的原子个数比为_________。
②原子坐标参数可表示晶胞内各原子的相对位置。图示晶胞中,原子坐标参数A为(0,0,0),B为(0,![]() ,
,![]() ),则C原子(底心)的坐标参数为__________。
),则C原子(底心)的坐标参数为__________。
③已知该立方晶胞的密度为![]() ,NA为阿伏加德罗常数的值,则晶胞参数a=______nm。
,NA为阿伏加德罗常数的值,则晶胞参数a=______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下HF酸性强于HCN,分别向1Ll mol/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积变化),溶液中 (X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
(X表示F或者CN)随pH变化情况如图所示,下列说法不正确的是
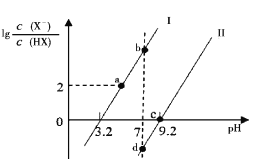
A.直线I对应的是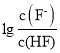
B.I中a点到b点的过程中水的电离程度逐渐增大
C.c点溶液中:![]()
![]()
D.b点溶液和d点溶液相比:cb(Na+)<cd(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据调查,劣质的家庭装饰材料会释放出近百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如图,图中“棍”代表单键或双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期。下面关于该有机物的叙述不正确的是

A.有机物化学式为C2HCl3B.可由乙炔和氯化氢加成得到
C.该有机物难溶于水![]() D.分子中所有原子在同一个平面内
D.分子中所有原子在同一个平面内
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com