
【题目】下图是探究温度对化学反应速率的影响的实验,其中三支试管中均为3 mL滴有FeCl3溶液的5% H2O2溶液(如下图所示)。
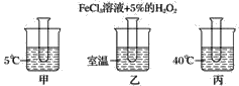
(1)三支试管内溶液产生氧气气泡速率由大到小为________。
(2)由上述实验可得出的结论为______________________。
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
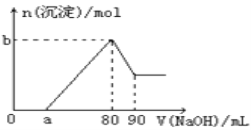
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验,回答问题:
(1)实验①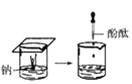 观察到的现象是________________________。实验②
观察到的现象是________________________。实验②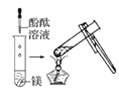 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③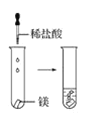 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④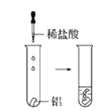 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
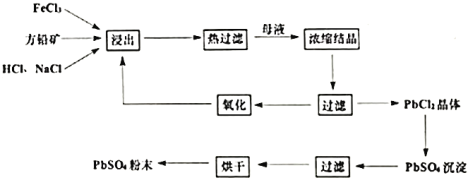
【题目】硫酸铅是一种重要的化工粉末材料,被广泛用于涂料和电池等行业。湿化学法从方铅矿(主要成分为![]() )直接制取硫酸铅粉末的转化流程图如下:
)直接制取硫酸铅粉末的转化流程图如下:
已知:①![]()
②![]()
![]()
回答下列问题:
(1)浸出过程中,产物中![]() 以
以![]() 形式存在,同时可观察到黄色沉淀,浸出过程中的反应的离子方程式为________________。反应后期,有少量气体产生,产生气体的化学方程式为________________。
形式存在,同时可观察到黄色沉淀,浸出过程中的反应的离子方程式为________________。反应后期,有少量气体产生,产生气体的化学方程式为________________。
(2)浓缩结晶过程中是将浸出液静置于冰水混合物中,从平衡角度解释使用冰水混合物的作用为________。
(3)氧化过程中通常加入![]() ,发生反应的离子方程式为__________。
,发生反应的离子方程式为__________。
(4)向![]() 固体中加入
固体中加入![]() ,发生反应的方程式为
,发生反应的方程式为![]()
![]() ,计算该反应的平衡常数为________。
,计算该反应的平衡常数为________。
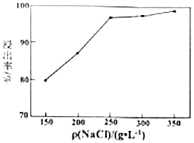
(5)单位体积溶液中加入![]() 的质量对方铅矿的浸出率的影响如图,高于
的质量对方铅矿的浸出率的影响如图,高于![]() 之后,浸出率基本不变,可能的原因是_____________。
之后,浸出率基本不变,可能的原因是_____________。
(6)传统工艺是经火法冶炼得到粗铅,然后电解精炼,再经高温熔融、氧化焙烧制取氧化铅,然后与硫酸反应制得硫酸铅。与传统工艺相比,湿化学法的优点是________(任写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:![]() 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为![]() 。
。
回答下列问题:
(1)![]() 发生裂变反应:
发生裂变反应:![]() ,净产生的中子(
,净产生的中子(![]() )数为________。基态
)数为________。基态![]() 原子的外围电子排布式为
原子的外围电子排布式为![]() ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
(2)![]() 和
和![]() 中,沸点较高的为________,与
中,沸点较高的为________,与![]() 形成的配离子稳定性较高的为________。
形成的配离子稳定性较高的为________。
(3)![]() 中存在大
中存在大![]() 键,形成该大
键,形成该大![]() 键的电子数为________。
键的电子数为________。
(4)某种铀氮化物的晶体结构与![]() 相同。
相同。![]() 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
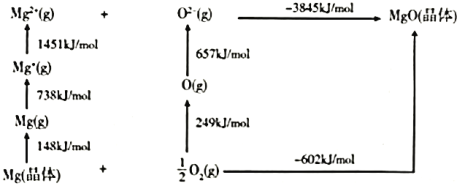
①![]() 晶格能为________
晶格能为________![]() 。
。
②![]() 的第二电离能大于
的第二电离能大于![]() 的第二电离能,是由于
的第二电离能,是由于![]() 的半径较
的半径较![]() 小、
小、![]() 的核电荷更高以及_______。
的核电荷更高以及_______。
(5)另一种铀氮化物的晶胞如下图所示,![]() “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
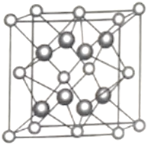
①铀元素的化合价为________,![]() “原子”的配位数为________。
“原子”的配位数为________。
②已知晶胞参数为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)。
(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
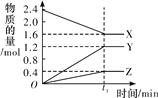
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.11.2 LCl2通入足量的NaOH 溶液中充分反应 ,转移的电子数为 0.5NA
B.4.4 g 由 CO2 和 N2O 组成的混合气体中含有的电子总数为 2.2NA
C.常温下 ,1.0L p H= l 的 H2SO4溶液中含有H+的数目为 0.2NA
D.11.5 g乙醇分子中含有C- H键的数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代污水处理工艺中常利用聚合铁在水体中形成絮状物,以吸附![]() 等重金属离子,聚合铁简称PFS,化学式为
等重金属离子,聚合铁简称PFS,化学式为![]() 。下列说法错误的是
。下列说法错误的是
元素 | Mn | Fe | |
电离能/kJ·mol-1 |
| 717 | 762 |
| 1509 | 1561 | |
| 3248 | 2957 | |
A.PFS中铁元素显+3价
B.基态铁原子的价电子排布式为![]()
C.由![]() 溶液制备PFS需经过氧化、水解和聚合等过程
溶液制备PFS需经过氧化、水解和聚合等过程
D.由表可知再失去一个电子时,气态![]() 比气态
比气态![]() 难
难
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com