
| A. | CO32- | B. | SO42- | C. | Cl- | D. | Na+ |
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙一定是弱碱 | B. | 甲一定是强碱 | C. | 乙一定是二元碱 | D. | 甲一定是一元碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
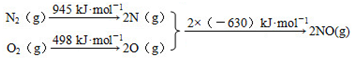

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
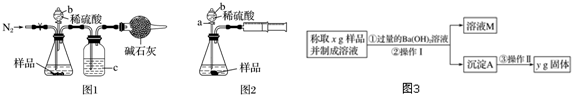
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
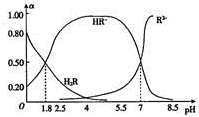 室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )
室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )| A. | H2R的一级电离平衡常数Kal≈0.25 | |
| B. | pH=2.5的H2R溶液中:c(HR-)+2c(R2-)+c(OH-)=l0-2.5 | |
| C. | pH=5.5的该溶液中:c(HR一)>c(R2一)>c(H+)>c(OH一) | |
| D. | 向pH=7的该溶液中滴加少量稀硫酸,a(HR-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
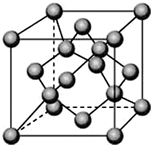 已知A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他3种元素既不在同一周期又不在同一主族.B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D原子的L层电子数与最外层电子数之比为4:1,其d轨道中有一对成对电子.请回答:
已知A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他3种元素既不在同一周期又不在同一主族.B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D原子的L层电子数与最外层电子数之比为4:1,其d轨道中有一对成对电子.请回答: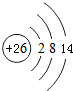 ,它的+3价离子的电子排布式为1s22s22p63s2sp5.
,它的+3价离子的电子排布式为1s22s22p63s2sp5.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com