
研究硫及其化合物的性质有重要意义。
(1)Cu2S在高温条件下发生如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ⊿H=-773kJ/mol
当该反应有1.2mol电子转移时,反应释放出的热量为 kJ。
(2)硫酸工业生产中涉及反应:2SO2(g)+O2(g) 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
①压强:P1 P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L) (14分)(1)77.3(2分)
(2)①<(2分) ② =(2分) ③ a b(2分) 0.08mol·L-1·min-1(2分)
(3)向左 (2分); 或0.17(2分)
或0.17(2分)
解析试题分析:(1)根据热化学方程式2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ⊿H=-773kJ/mol可知,每放出773kJ能量,反应中就转移12mol电子(氧气是氧化剂,1分子氧气得到4个电子),所以当该反应有1.2mol电子转移时,反应释放出的热量为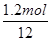 ×773kJ/mol=77.3kJ。
×773kJ/mol=77.3kJ。
(2)①根据图像可知,在温度相同时,P2曲线表示的SO2转化率大于P1曲线表示的SO2转化率。由于正反应是体积减小的可逆反应,增大压强平衡向正反应方向移动,SO2转化率增大,所以压强是P1<P2。
②对于特定的可逆反应,平衡常数只与温度有关系,A、B两点的温度相同,所以两点对应的平衡常数相等。
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。根据表中数据可知,反应前SO2和氧气的(0.4+1.6)mol/L=2.0mol/L和(1.2+1.6÷2)mol/L=2.0mol/L,即反应物的起始浓度不是按照化学计量数之比冲入的,所以当SO2和O2的体积比保持不变时,可以说明反应调动平衡状态,a正确;该反应是体积减小的可逆反应,所以容器内气体的压强是减小的,因此当压强不再发生变化时,可以说明达到平衡状态,b正确;密度是混合气的质量和容器容积的比值,在反应过程中气体的质量和容积始终是不变的,因此密度始终是不变的,因此选项c不能说明;根据S原子守恒可知,SO2和SO3物质的量之和始终保持不变,d不能说明,答案选ab。在0~10min内,氧气的浓度减少0.8mol/L,则υ(O2)=0.8mol/L÷10min=0.08mol·L-1·min-1。
(3)SO2溶于水生成亚硫酸,亚硫酸是酸,电离出氢离子,抑制水的电离,则溶液中水的电离平衡向左移动。根据亚硫酸的第二步电离方程式HSO3-+H2O SO32-+H+可知,Ka2=
SO32-+H+可知,Ka2= ,则
,则 =
= =
= =
= 或0.17。
或0.17。
考点:考查反应热的计算、外界条件对平衡状态的影响、平衡状态的判断、平衡常数的应用、反应速率的计算。外界条件对水电离平衡的影响、电离常数的计算和应用


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g) W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
⑴上述反应的化学平衡常数表达式为___________________________。
⑵某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应_____________________(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
 W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1  W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1  WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。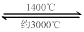 WI4 (g)。下列说法正确的有____________。
WI4 (g)。下列说法正确的有____________。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1,
C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1,
Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式是:
(2)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g),写出该反应的化学平衡常数表达式:
2SO3(g),写出该反应的化学平衡常数表达式:
(3)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为: 。
(4)无水AlCl3瓶盖打开有白雾,其反应的化学方程式为 。
(5)“镁—次氯酸盐”燃料电池,其装置示意图如图,该电池反应的总反应方程式为_____________________。
(6)工业上电解饱和食盐水的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
运用反应原理研究氮、硫、氯、碘及其化合物的反应有重要意义。
(1)在反应:2SO2(g)+O2(g) 2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):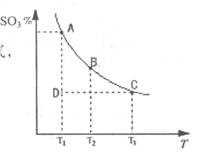
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向左”、“向右”或“不”);
2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向左”、“向右”或“不”);
②当温度为T1,反应进行到状态D时,V正 V逆(填“>”、“<”或“=”)。
(2)①下图是一定条件下,N2和H2发生可逆反应生成1mol NH3的能量变化图,该反应的热化学反应方程式 。(△H用含Q1、Q2的代数式表示)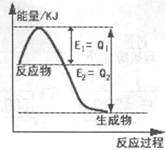
②25°C时,将a mol ? L―1的氨水与b mol ? L―1的盐酸等体积混合,所得溶液的pH=7,则c (NH4+) c(Cl―),a b(填“>”、“<”或“=”);
(3)海水中含有大量以化合态形式存在的氯、碘元素。已知:250C时,Ksp(AgCl)=1.6×10―10mol2?L―2、Ksp(AgI)=1.5×10―16mol2?L―2。
在 250C时,向 10mL0.002mol?L―1的 NaCl溶液中滴入 10mL0.002mol?L―1AgNO3溶液,有白色沉淀生成,向所得浊液中继续滴人0.1mol ?L―1的NaI溶液,白色沉淀逐渐转化为黄色沉淀,其原因是 ,该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨工业对国防具有重要意义,如制硝酸、合成纤维以及染料等
(1)已知某些化学键的键能数据如下表:
| 化学键 | N≡N | H—H | N—H |
| 键能kJ·mol-1 | 946 | 436 | 390 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同): 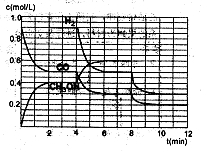
①下列说法正确的是
| A.起始时n(H2)为1.7mol |
| B.当容器内压强恒定时,说明反应达到平衡状态 |
| C.4分钟时,改变的条件是升高温度 |
| D.7分钟时,v(CO)=v(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题: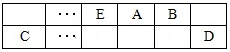
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式 。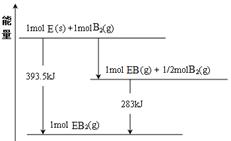
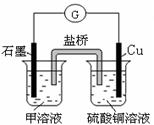
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)硫化物在自然界中的部分循环关系如下。
(1)H2S在空气中可以燃烧。
已知: 2H2S(g) + O2(g)  2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol ①
2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol ①
S(s) + O2(g)  SO2(g) ΔH=-297.04 kJ/mol ②
SO2(g) ΔH=-297.04 kJ/mol ②
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
(4)SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g) + 4H2(g) CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1
CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1
已知:CO(g) + H2O(g) CO2(g)+H2(g) △H=" —41.2" kJ·mol-1
CO2(g)+H2(g) △H=" —41.2" kJ·mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g) +6H2(g) CH3CH2OH(g) +3H2O(g) △H = 。
CH3CH2OH(g) +3H2O(g) △H = 。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。
①某研究小组在实验室以Ag– ZSM– 5为催化剂,测得NO转化为N2的转化率随温度变化情况如下图。若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在 左右。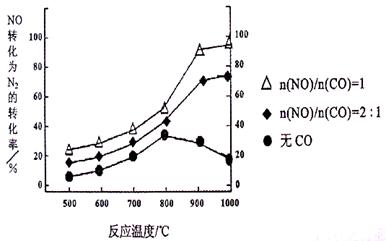
②用活性炭还原法处理氮氧化物。有关反应为:C (s) +2NO2(g) N2 (g) + CO2 (g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2 (g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com