
分析 (1)常用的水处理剂,可知铁离子水解生成胶体,则为+3价铁;
(2)a.均含金属离子与配位离子之间的离子键,配位离子中含配位键;
b.不存在NH3分子;
c.非金属性最强的为F,其电负性最大;
d.由化学式可知,配位数均为6;
(3)根据配合物结构判断,Cu2+提供空轨道,NH3和NF3中中心原子N原子提供孤电子对,根据NH3和NF3中共用电子对的偏转判断;
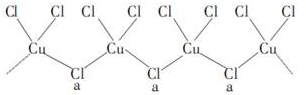
(4)据图知a位置上的Cl原子形成了2个σ键,同时还有2个孤电子对,其杂化轨道类型为sp3杂化;由于铜的化合价有+1、+2,已知KCuCl3中铜为+2价,则+1价的铜形成化合物的化学式为K2CuCl3;
(5)铜的晶胞为面心立方最密堆积,根据其晶胞的堆积类型判断,三个铜原子相切,形成晶胞的面对角线,由此得到铜原子半径;根据铜摩尔质量=摩尔体积×密度计算.
解答 解:(1)常用的水处理剂,可知铁离子水解生成胶体,则为+3价铁,则铁离子的电子排布为1s22s22p63s23p63d5或[Ar]3d5,
故答案为:1s22s22p63s23p63d5或[Ar]3d5;
(2)a.晶体中存在化学键类型为配位键和离子键,故a正确;
b.[Cu(NH3)4]SO4中铜离子和氨分子之间形成配位键,不存在NH3分子,其水溶液中也不含有大量NH3分子,故b错误;
c.三种物质的组成元素中第一电离能最大的是氟元素,故c错误;
d.K4[Fe(CN)6]与Na3[AlF6]的中心离子具有相同的配位数,均为6,故d正确;
故答案为:ad;
(3)根据配合物结构判断,Cu2+提供空轨道,NH3和NF3中中心原子N原子提供孤电子对,由于N、H、F三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键,
故答案为:N、H、F三种元素的电负性为F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难于与Cu2+形成配位键;
(4)a位置上Cl原子成2个单键,含有2对孤对电子,杂化轨道数为4,杂化轨道类型为:sp3,
一种化合物的化学式为KCuCl3,其中铜元素为+2价,故另一种化合物中铜为+1价,CuCl3原子团的化合价为-2,其化学式为K2CuCl3,
故答案为:sp3杂化;K2CuCl3;
(5)根据铜晶胞为面心立方最密堆积,由边长可计算出晶胞的体积V=(361 pm)3≈4.70×10-23 cm3,根据m=ρ×V=9.00 g•cm-3×4.70×10-23cm3=4.23×10-22g;
由于一个铜晶胞中含有的铜原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4(个),每个铜原子的体积约为=4.70×10-23 cm3÷4=1.18×10-23 cm3,则$\frac{1}{6}$×π×d3=1.18×10-23 cm3,解得铜原子的直径d≈255pm;NA=$\frac{63.6g/mol}{\frac{1}{4}×4.23×1{0}^{-22}g}$≈6.05×1023mol-1,
故答案为:255;6.05×1023.
点评 本题考查物质结构和性质,涉及核外电子排布、电离能、配位键、晶体结构等知识点,晶胞计算是该题的难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铝的导热性能较好,应大力提倡用铝炊具 | |
| B. | 铝制器具不宜盛放食品较长时间(如放入冰箱中过夜等) | |
| C. | 明矾可用于饮用水的杀菌消毒 | |
| D. | 小孩可以食用含铝较多的食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
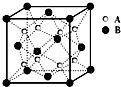 某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )
某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )| A. | B2A | B. | BA2 | C. | B7A4 | D. | B4A7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
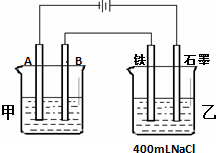 如图所示为相互串联的甲、乙两个电解池,试回答:
如图所示为相互串联的甲、乙两个电解池,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液和稀硫酸反应:Ba2++SO42-=BaSO4↓ | |
| B. | 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 钠放于水中:2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
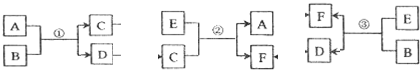
 ;反应③的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
;反应③的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
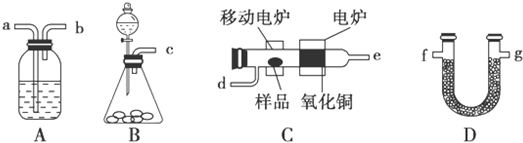
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com