
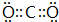
分析 X、Y、Z、W四种元素都是短周期元素,且原子序数W>Z>Y>X.X的阳离子半径是自然界中离子半径最小的,则X为H元素;W原子的最外层电子数为其电子层数 的3倍,原子只能有2个电子层,最外层电子数为6,故E为O元素;结合原子序数可知Y、Z处于第二周期,X(氢)与Y的原子的最外层电子数之和与Z原子最外层电子数相等,则Y、Z相邻,W和 Y原子的最外层电子数之和是Z原子最外层电子数的2倍,设Y最外层电子数为x,则Z的最外层电子数为x+1,故8+x=2(x+1),解得x=6,故Y为C元素,Z为N元素.
解答 解:X、Y、Z、W四种元素都是短周期元素,且原子序数W>Z>Y>X.X的阳离子半径是自然界中离子半径最小的,则X为H元素;W原子的最外层电子数为其电子层数 的3倍,原子只能有2个电子层,最外层电子数为6,故E为O元素;结合原子序数可知Y、Z处于第二周期,X(氢)与Y的原子的最外层电子数之和与Z原子最外层电子数相等,则Y、Z相邻,W和 Y原子的最外层电子数之和是Z原子最外层电子数的2倍,设Y最外层电子数为x,则Z的最外层电子数为x+1,故8+x=2(x+1),解得x=6,故Y为C元素,Z为N元素.
(1)由上述分析可知,X为H、Y为C、Z为N、W为O,
故答案为:H;C;N;O;?
(2)上述元素单质中碳元素单质为固体,其它单质均为气体,故碳元素单质的熔点最高,
故答案为:C;?
(3)Y与W构成的最高价化合物为CO2,电子式为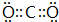 ,
,
故答案为: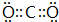 ;
;
(4)由上述四种元素组成的离子化合物在300℃完全分解为气态混合物,常见化合物中碳酸铵、碳酸氢铵等符合,且混合气体的平均相对分子质量为24,1mol碳酸氢铵分解得到1mol氨气、1mol水蒸气、1mol二氧化碳,平均相对分子质量为$\frac{79}{3}$=26.3,不符合题意,而1mol碳酸铵分解得到2mol氨气、1mol水蒸气、1mol二氧化碳,平均相对分子质量为$\frac{96}{4}$=24,符合题意,故该离子化合物的化学式是(NH4)2CO3,
故答案为:(NH4)2CO3.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,(4)为本题的难点,由四种元素形成的离子化合物很多,通过猜测验证进行解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| X | Y | Z | |
| R | |||
| W | |||
| J |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
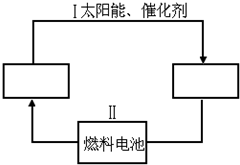 能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题.
能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |
| B | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com