
| A. | 二氧化硫具有漂白性,能使氯水褪色 | |
| B. | 浓硫酸具有较强酸性,能使Cu转化为Cu2+ | |
| C. | 硅具有还原性,一定条件下能将铁从其氧化物中置换出来 | |
| D. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 |
分析 A.二氧化硫具有还原性,能够与氯水反应生成硫酸和盐酸;
B.依据铜与浓硫酸反应中硫元素化合价变化判断浓硫酸的性质;
C.依据硅化合价判断;
D.过氧化氢分解生成氧气和水,反应中二氧化锰起催化作用.
解答 解:A.二氧化硫与氯水反应生成硫酸和盐酸,使氯水褪色,体现二氧化硫的还原性,与漂白性无关,故A错误;
B.铜与浓硫酸反应生成硫酸铜、二氧化硫和水,硫酸中部分硫元素化合价降低、部分化合价不变,浓硫酸表现强的氧化性和酸性,使铜化合价升高体现浓硫酸的强的氧化性,故B错误;
C.硅单质中硅化合价为0,处于低价,一定条件下能将铁从其氧化物中置换出来,体现其还原性,故C正确;
D.过氧化氢分解生成氧气和水,反应中二氧化锰起催化作用,故D错误;
故选:C.
点评 本题考查了元素化合物性质,熟悉二氧化硫、浓硫酸、硅、过氧化氢性质是解题关键,注意催化剂参加反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
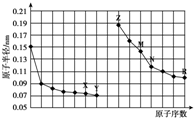
| A. | 最高价氧化物对应水化物的碱性:Z<M | |
| B. | Y、R两种元素气态氢化物的沸点:Y<R | |
| C. | 简单离子的半径:M<Z<X | |
| D. | X、N两种元素组成的化合物一定不与酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
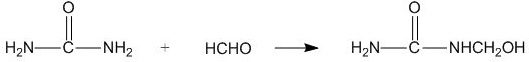
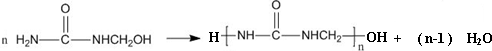
| A. | 合成脲醛塑料的反应为加聚反应 | |
| B. | 尿素与氰酸铵 ( NH4CNO ) 互为同系物 | |
| C. | 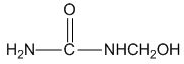 能发生水解反应 能发生水解反应 | |
| D. | 脲醛塑料平均相对分子质量为10000,平均聚合度为111 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
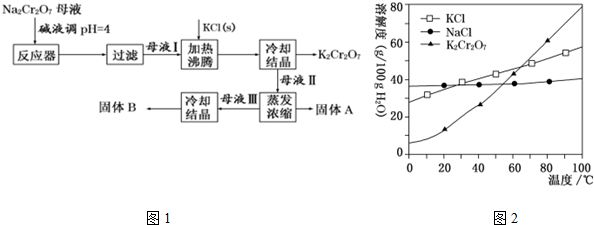
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/LCH3COOH溶液中所含分子总数 | |
| B. | 1molCl2参加化学反应获得的电子数 | |
| C. | 常温常压下,11.2LN2和NO的混合气体所含的原子数 | |
| D. | 28g铁在反应中作还原剂时,失去电子的数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

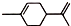 ),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为
),则A的系统命名是2-甲基-1,3-丁二烯.在合成M的过程中还可以生成M的一种同分异构体,其结构简式为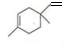 .
.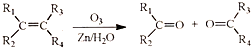 (R1、R2、R3、R4为烃基或氢原子)
(R1、R2、R3、R4为烃基或氢原子)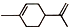 )发生上述反应的产物中分子量较大的结构简式
)发生上述反应的产物中分子量较大的结构简式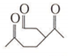 .
.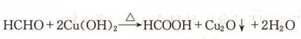 .
.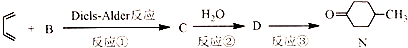
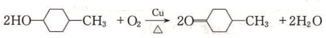 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
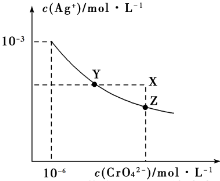
| A. | 在 t℃时,AgCl 的溶解度大于 Ag2CrO4 | |
| B. | 在 t℃时,Ag2CrO4的 Ksp=1×10-1210-3 | |
| C. | 在饱和 Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X 点 | |
| D. | 在 t℃时,用 AgNO3 标准溶液滴定 20mL 未知浓度的 KCl 溶液,不能采用K2CrO4溶液为指示剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com