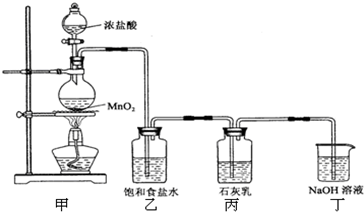
解:(1)A.发生反应为:C+O
2
CO
2,由方程式可知,一方面消耗O
2的体积等于生成CO
2的体积,广口瓶内液面不会上升,步骤2中就无需调节广口瓶内外液面相平.另一方面生成的CO
2可以与Mg反应,致使蒸发皿中得到的固体含有MgO.故A错误;
B.废广口瓶中的气体为空气,而铁在纯氧中可以燃烧,在空气中无法引燃.故B错误;
C.红磷在空气中燃烧,生成固体五氧化二磷,4P+5O
2
2P
2O
5,除去广口瓶中的氧气,导致广口瓶内压强减小,液面上升,故C正确;
故答案为:C;
(2)由图知,无底的废广口瓶的底部与水槽底部相接,除去广口瓶内空气中的氧气后,导致广口瓶内水面上升,广口瓶外水面就下降,要调节广口瓶内外液面相平,最直接就是向水槽中加水,故答案为:向水槽中加水;
(3)Mg
3N
2由阳离子Mg
2+和阴离子N
3-组成,溶于足量盐酸时,可看成先和水反应,生成的产物再和盐酸反应,
第一步反应Mg
3N
2+6H
2O═3Mg(OH)
2↓+2NH
3↑(H
2O电离出H
+和OH
-,Mg
2+和OH
-结合成Mg(OH)
2,N
3-和H
+结合成NH
3),
第二步Mg(OH)
2和NH
3再与盐酸反应,生成MgCl
2和NH
4Cl,最后合并得总反应为Mg
3N
2+8HCl=3MgCl
2+2NH
4Cl.
故答案为:Mg
3N
2+8HCl=3MgCl
2+2NH
4Cl;
(4)步骤4中取蒸发皿中得到的固体,加盐酸溶解.向溶液中加入过量氢氧化钠溶液,有白色沉淀生成,同时得到一种能使湿润红色石蕊试纸变蓝的气体.该气体为碱性气体NH
3,说明蒸发皿中得到的固体为Mg
3N
2.如果直接将镁条在空气中点燃,空气中存在N
2、O
2、CO
2,三者都能与镁反应(N
2+3Mg

Mg
3N
2、O
2+2Mg

2MgO、CO
2+2Mg

2MgO+C),但氧气比氮气活泼,氧气首先与镁反应生成MgO(与CO
2反应也是生成MgO),进行步骤4中实验时,无NH
3生成,不能使湿润红色石蕊试纸变蓝.
故答案为:氧气比氮气活泼,与镁反应生成MgO;
(5)金属性强弱依据有:①看该金属与水反应的难易,与水反应越容易,金属性越强,②看该金属与酸反应的难易,与酸反应越容易,金属性越强,③看该金属最高价氧化物对应水化物的碱性强弱,碱性越强,该金属金属性越强,
在MgCl
2溶液和AlCl
3溶液中分别加NaOH 溶液至过量,发生反应MgCl
2+2NaOH═2NaCl+Mg(OH)
2↓、AlCl
3+3NaOH═3NaCl+Al(OH)
3↓、Al(OH)
3+NaOH═NaAlO
2+2H
2O,可见MgCl
2溶液中产生沉淀且不消失,
AlCl
3溶液中产生沉淀后完全溶解.说明Al(OH)
3为两性氢氧化物,得Mg(OH)
2的碱性强于Al(OH)
3的碱性,故Mg的金属性强于Al的金属性,
故答案为:在MgCl
2 溶液和AlCl
3 溶液中分别加NaOH 溶液至过量;MgCl
2溶液中产生沉淀且不消失,AlCl
3溶液中产生沉淀后完全溶解.
分析:(1)题意要求氧气消耗掉,同时广口瓶中压强减小液面上升,分析炭粉、铁粉、红磷与氧气的反应产物及反应条件,即可确定正确选项;
(2)通过审题、分析装置图,即可确定广口瓶内水面高于广口瓶外水面,从而采取正确方法使内外液面相平;
(3)由题意知,反应物已知,要写化学方程式关键在于确定出生成物,生成物的确定可把Mg
3N
2看成先与水反应,然后产物再与盐酸反应;
(4)掌握空气中的成分与镁反应的方程式,结合步骤4中要得到一种能使湿润红色石蕊试纸变蓝的气体,即可确定蒸发皿中的固体应为Mg
3N
2,再进一步分析氧气和氮气与镁反应的活泼性;
(5)金属性强弱依据有:①看该金属与水反应的难易,与水反应越容易,金属性越强,②看该金属与酸反应的难易,与酸反应越容易,金属性越强,③看该金属最高价氧化物对应水化物的碱性强弱,碱性越强,该金属金属性越强.根据③设计不同的实验方案.
点评:本题考查元素及其化合物,首先要熟悉物质的化学性质及化学用语,其次要认真审题,结合题目的已知条件进行分析,得出结论.

 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究. CO2,由方程式可知,一方面消耗O2的体积等于生成CO2的体积,广口瓶内液面不会上升,步骤2中就无需调节广口瓶内外液面相平.另一方面生成的CO2可以与Mg反应,致使蒸发皿中得到的固体含有MgO.故A错误;
CO2,由方程式可知,一方面消耗O2的体积等于生成CO2的体积,广口瓶内液面不会上升,步骤2中就无需调节广口瓶内外液面相平.另一方面生成的CO2可以与Mg反应,致使蒸发皿中得到的固体含有MgO.故A错误; 2P2O5,除去广口瓶中的氧气,导致广口瓶内压强减小,液面上升,故C正确;
2P2O5,除去广口瓶中的氧气,导致广口瓶内压强减小,液面上升,故C正确; Mg3N2、O2+2Mg
Mg3N2、O2+2Mg 2MgO、CO2+2Mg
2MgO、CO2+2Mg 2MgO+C),但氧气比氮气活泼,氧气首先与镁反应生成MgO(与CO2反应也是生成MgO),进行步骤4中实验时,无NH3生成,不能使湿润红色石蕊试纸变蓝.
2MgO+C),但氧气比氮气活泼,氧气首先与镁反应生成MgO(与CO2反应也是生成MgO),进行步骤4中实验时,无NH3生成,不能使湿润红色石蕊试纸变蓝.



 [AgI2]-
[AgI2]-

 某化学兴趣小组使用酸碱中和滴定法测定市售白醋(主要成分为CH3COOH)的总酸量(g/100ml).
某化学兴趣小组使用酸碱中和滴定法测定市售白醋(主要成分为CH3COOH)的总酸量(g/100ml). 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.