
| A. | 碳酸氢钠溶液跟少量的饱和石灰水反应2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 向氢氧化钠溶液中加入稀醋酸 OH-+H+═H2O | |
| C. | 向氯化铁溶液中加入铁粉 Fe+FeCl3=2Fe2++3Cl- | |
| D. | Ca(ClO)2溶液中通入过量的二氧化硫气体Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO |
分析 A.石灰水少量,离子方程式按照氢氧化钙的化学式组成书写,钙离子不足,反应中碳酸根离子过量;
B.醋酸为弱电解质,离子方程式中醋酸不能拆开;
C.氯化铁为可溶性强电解质,离子方程式中应该拆开;
D.次氯酸具有强氧化性,亚硫酸钙被氧化成硫酸钙沉淀.
解答 解:A.碳酸氢钠溶液跟少量的饱和石灰水,反应生成碳酸钙沉淀、碳酸钠和水,反应的离子方程式为:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O,故A正确;
B.向氢氧化钠溶液中加入稀醋酸,反应生成醋酸钠和水,醋酸不能拆开,正确的离子方程式为:OH-+CH3COOH=H2O+CH3COO-,故B错误;
C.向氯化铁溶液中加入铁粉,反应生成氯化亚铁,正确的离子方程式为:Fe+2Fe3+=3Fe2+,故C错误;
D.亚硫酸钙被次氯酸氧化,正确的离子方程式为:Ca2++2ClO-+2H2O+2SO2═CaSO4↓+SO42-+4H++2Cl-,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,题目难度中等,明确发生的化学反应是解答本题的关键,反应的先后顺序及与量有关的离子反应为解答的难点,选项D为易错点,不要忽略发生的氧化还原反应.


科目:高中化学 来源: 题型:多选题
| A. | SO2气体通入石蕊试液中,溶液先变红后褪色 | |
| B. | 在KI-淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 | |
| C. | 标准状况下,22.4 L任何气体中都含有6.02×1023个分子 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
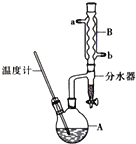 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下| 相对分 子质量 | 沸点/ ℃ | 密度 (g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
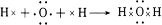 .
. ,属于离子化合物(填“离子化合物”,“共价化合物”)
,属于离子化合物(填“离子化合物”,“共价化合物”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
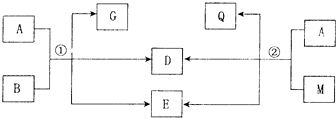
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
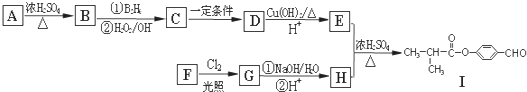
 .
. .E与H反应生成I的方程式为
.E与H反应生成I的方程式为 .
.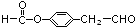 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠跟水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | 碳酸氢钙溶液加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| D. | 碳酸氢钠溶液中加入盐酸:HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.40mL | 18.50mL |
| 第二次 | 1.30mL | 18.05mL |
| 第三次 | 3.10mL | 21.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1mol/L的 pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 25℃时,pH=9、浓度均为0.1 mol/L的NH3•H2O和NH4Cl混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| C. | NaHCO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com