
 .
. 分析 (1)用银离子沉淀氯离子,A为硝酸银;检验加入的A是否过量也就是检验氯离子是否沉淀完全;
(2)测定表面有杂质,称量沉淀质量增大,氯化钠含量增大,味精的纯度减小;
(3)为防止沉淀分解应低温烘干;
(4)沉淀为氯化银,根据氯离子守恒计算味精中氯化钠的质量分数,得到味精纯度;
(5)味精和食盐中都含有的元素为钠元素,钠原子失去最外层电子得到钠离子;
解答 解:(1)用银离子沉淀氯离子,A为硝酸酸化的硝酸银溶液;检验加入的A是否过量也就是检验氯离子是否沉淀完全,方法是取上层烧杯中清液于试管中加入少量硝酸银溶液,如果有沉淀产生说明不过量,如果没有沉淀产生说明过量,
故答案为:硝酸银溶液;取上层烧杯中清液于试管中加入少量硝酸银溶液,如果有沉淀产生说明不过量,如果没有沉淀产生说明过量;
(2)沉淀洗涤是必不可少的一步,若沉淀不洗涤,称量沉淀质量增大,氯化钠含量增大,味精的纯度减小,测得的结果将偏低,
故答案为:偏低;
(3)为防止沉淀分解,烘干沉淀应采用的方法是低温烘干,
故答案为:A;
(4)沉淀为氯化银,氯化银与氯化钠的物质的量相等,则味精中氯化钠的质量分数为:$\frac{\frac{0.368g}{143.5g/mol}×58.5g/mol}{1.000g}$×100%=15.0%,则味精的纯度为85.0%,
故答案为:85.0%;
(5)味精和食盐中都含有的元素为钠元素,钠原子失去最外层电子得到钠离子,钠离子核电荷数为11,核外电子数为10,钠离子正确的结构示意图为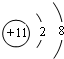 ,
,
故答案为: .
.
点评 本题考查物质含量的测定,涉及实验操作、定性检验、定量计算等知识,注意实验操作文字阐述的准确性,题目难度中等.


科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:选择题
有些古文或谚语包含了丰富的化学知识,下列解释不正确的是( )
选项 | 古文或谚语 | 化学解释 |
A | 日照香炉生紫烟 | 碘的升华 |
B | 以曾青涂铁,铁赤色如铜 | 置换反应 |
C | 煮豆燃豆萁 | 化学能转化为热能 |
D | 雷雨发庄稼 | 自然固氮 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省绵阳市高一上第一次月考化学试卷(解析版) 题型:选择题
实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ②固定铁圈位置③放上蒸发皿 ④加热搅拌 ⑤停止加热、余热蒸干 其正确的操作顺序为
A. ②③④⑤ B. ①②③④⑤ C. ②③①④⑤ D. ②①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | |||
| 2 | 锥形瓶中液体含大量 | ||
| 3 | 锥形瓶中液体含大量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 左室中NaOH的浓度不变 | |
| B. | 工作时,OH-向左迁移 | |
| C. | 右室电极反应为C2H5OH+5OH--4e-=CH3COO-+4H2O | |
| D. | 右室生成CH3COONa1.5mol,理论上左室生成氢气67.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
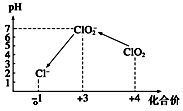 二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com