
从H+、Na+、Cu2+、Ba2+、Cl-、SO42-离子中,选出恰当的离子组成一种电解质,将电解质溶液按下列要求进行电解(均是惰性电极):
(1) 电解时电解质含量减小,水量不变,则所采用的电解质是 ;
(2)电解时电解质的质量保持不变,水量减小,则所采用的电解质是 ;
(3)电解时电解质和水的质量都发生变化,则所采用的电解质是 ;
科目:高中化学 来源: 题型:
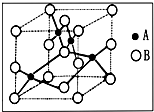 (2013?临沂二模)[化学--物质结构与性质]金属铜广泛地应用于电气、机械制造、国防等领域.
(2013?临沂二模)[化学--物质结构与性质]金属铜广泛地应用于电气、机械制造、国防等领域.| 320 |
| a3NA |
| 320 |
| a3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2mNA |
| M |
| 2mNA |
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

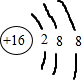
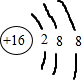
| ||
| △ |
| ||
| △ |
| T/K | 303 | 313 | 323 |
| CA2生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实 验 混合溶液 |
A | B | C | D | E | F |
| 4mol?L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | 15 | 10 | 0 |
| 组别 | c(HA)/mol?L-1 | c(NaOH)/mol?L-1 | 混合液pH |
| 甲 | c | 0.2 | pH=7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
《有机化学基础》模块试题
1.有机黏合剂的黏合过程是液态的小分子黏合剂经化学反应转化为大分子或高分子而固化。
(1)“502胶”是一种快干胶,其主要成分为α氰基丙烯酸乙酯(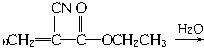 ),请写出“502胶”发生黏合作用的化学方程式:_____________________________;反应类型是_____________。
),请写出“502胶”发生黏合作用的化学方程式:_____________________________;反应类型是_____________。
(2)厌氧胶(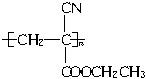 )也是一种黏合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种黏合剂,该物质的名称是_____________;请写出这一制取过程的化学方程式_________________。
)也是一种黏合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种黏合剂,该物质的名称是_____________;请写出这一制取过程的化学方程式_________________。
(3)白乳胶是常用的黏合剂,其主要成分为醋酸乙烯酯(CH3COOCH=CH2),它有多种同分异构体,如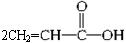 、
、 、
、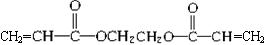 。已知含有
。已知含有![]() 结构的物质不能稳定存在。请另外写出3种含—CH=CH—结构的链状同分异构体的结构简式:______________、______________、______________。
结构的物质不能稳定存在。请另外写出3种含—CH=CH—结构的链状同分异构体的结构简式:______________、______________、______________。
(4)已知醇和醛可以发生反应:2CH3OH+HCHO![]() CH3OCH2OCH3+H2O,聚乙烯醇可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力黏合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:________________。
CH3OCH2OCH3+H2O,聚乙烯醇可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力黏合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:________________。
《物质结构与性质》模块试题2.如下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
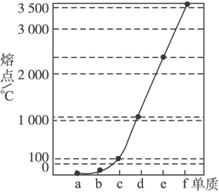
(1)请写出上图中d单质对应元素原子基态时的电子排布式_____________。
(2)单质a、f、b对应的元素以原子个数比1∶1∶1形成的分子中含_____________个σ键,_____________个π键。
(3)a与b的元素形成的10电子中性分子X的空间构型为_____________;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为________
_______,其中X与d的高价离子之间以_____________键结合。
(4)上述六种元素中的一种元素形成的含氧酸的结构为:![]() ,该含氧酸的分子式为_____________,请简要说明该物质易溶于水的原因__________________________。
,该含氧酸的分子式为_____________,请简要说明该物质易溶于水的原因__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com