
铜及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS)。写出CuSO4转变为铜蓝的离子方程式_______________________________。
(2)工业上以黄铜矿CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
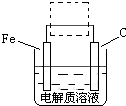
(3)图I是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图II是粗铜精炼的装置图,假若用燃料电池为电源进行粗铜的精炼实验。
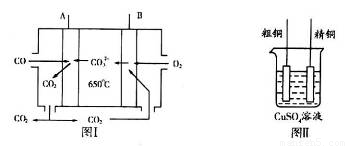
①写出A极的电极反应式__________________________________________________。
②要用燃料电池为电源进行粗铜的精炼实验,粗铜板应与__________极(填“A”或“B”)相连;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为___________。
③当消耗标准状况下1.12LCO时,精铜电极的质量变化情况为_________。
(4)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是________(填序号)
A.Ksp(CuCO3)<Ksp(CaCO3) B.c(Cu2+)<c(Ca2+)
C.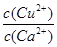 >
>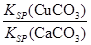 D.
D.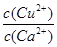 <
<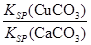
(14分)(1)Cu2+(aq)+ZnS(s)=Zn2+(aq)+CuS(s) (2分)
(2)Cu2O和Cu2S(1分);将气体通入品红溶液,溶液褪色,加热恢复原色(2分)
(3)①CO-2e-+CO32-=2CO2(2分) ②B(1分);Au、Ag以单质的形成沉积在阳极下方,Fe以Fe2+的形式进入电解液中(2分) ③增加3.2g(2分) (4)C(2分)
【解析】
试题分析:(1)硫化铜的溶解度小于氯化锌的,所以根据沉淀容易向更难溶的方向转化可知,该反应的离子方程式是Cu2+(aq)+ZnS(s)=Zn2+(aq)+CuS(s)。
(2)根据反应的方程式可知,铜元素的化合价从+1价降低到0价,得到1个电子,S元素的化合价从-2价升高到+4价,失去6个电子,所以Cu2S是还原剂,Cu2O和Cu2S是氧化剂。SO2具有漂白性,能使品红溶液褪色,据此可以鉴别SO2,所以正确的操作是将气体通入品红溶液,溶液褪色,加热恢复原色。
(3)①原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。因此CO在负极通入,氧气在正极通入,即A电极是负极。由于电解质是一定比例的Li2CO3和Na2CO3熔融混合物为电解质,所以CO32-向负极移动,因此负极电极反应式是CO-2e-+CO32-=2CO2。
②粗铜精炼时,粗铜与电源的正极相连,做阳极,即与电极B相连。由于金属性是Au<Ag<Cu<Fe,所以阳极首先是铁失去电子,然后是铜失去电子,而Au和Ag形成阳极泥,所以Au、Ag、Fe它们在电解槽中的存在形式和位置为Au、Ag以单质的形成沉积在阳极下方,Fe以Fe2+的形式进入电解液中。
③准状况下1.12LCO的物质的量是1.12L÷22.4L/mol=0.05mol,反应中转移电子的物质的量是0.05mol×2=0.1mol,所以根据电荷守恒可知,精铜电极析出铜的物质的量是0.1mol÷2=0.05mol,即阴极精铜增加0.05mol×64g/mol=3.2g。
(4)向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,这说明溶液中c(Cu2+)·c(CO32-)>Ksp(CuCO3)、c(Ca2+)·c(CO32-)<Ksp(CaCO3),所以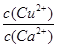 >
>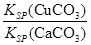 ,因此答案选C。
,因此答案选C。
考点:考查溶解平衡以及沉淀的转化;氧化还原反应的判断;SO2的检验;电极反应式的书写以及有关计算;粗铜的精炼等


科目:高中化学 来源: 题型:
 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为
溶液的pH为查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源:2011年山东省实验中学高考化学二模试卷(解析版) 题型:解答题
 6SO2+Fe3O4,氧化产物为______,若有3mol FeS2参加反应,转移电子的物质的量为______.
6SO2+Fe3O4,氧化产物为______,若有3mol FeS2参加反应,转移电子的物质的量为______. 一起净水,其原理为______(用离子方程式表示).
一起净水,其原理为______(用离子方程式表示). 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为______(溶液体积变化忽略不计).
溶液的pH为______(溶液体积变化忽略不计).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com