

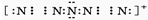 .
. 分析 由元素在周期表的位置可知,①~⑩分别为N、Na、K、Mg、Al、C、O、Cl、I、Fe,
(1)⑥含有8个中子的原子为C原子,质量数为14;元素⑦的氢化物与⑧的单质反应生成盐酸和HClO;
(2)Fe的原子序数为26;
(3)比较④和Cs的金属性,结合同周期从左向右金属性减弱、同主族从上到下金属性增强分析;
(4)“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排列成V形.如果5个N结合后都达到8电子结构,且含有2个N≡N键,中间N原子上有2对孤对电子.
解答 解:由元素在周期表的位置可知,①~⑩分别为N、Na、K、Mg、Al、C、O、Cl、I、Fe,
(1)表中⑥含有8个中子的原子的化学符号为146C,元素⑦的氢化物与⑧的单质反应的离子方程式为Cl2+H2O=H++Cl-+HClO,
故答案为:146C;Cl2+H2O=H++Cl-+HClO;
(2)Fe的原子序数为26,核外电子排布式为1s22s22p63s23p63d64s2,故答案为:1s22s22p63s23p63d64s2;
(3)因同周期从左向右金属性减弱、同主族从上到下金属性增强,则比较④和Cs的金属性,可选择Na或 Ba作中介或桥梁进行比较,
故答案为:Na或 Ba;
(4)“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排列成V形.如果5个N结合后都达到8电子结构,且含有2个N≡N键,中间N原子上有2对孤对电子,其电子式为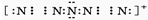 ,故答案为:
,故答案为: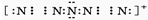 .
.
点评 本题考查位置、结构与性质,为高频考点,把握元素化合物知识、电子排布、金属性比较为解答的关键,侧重分析与应用能力的考查,注意(4)为解答的难点,题目难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| t/s | 0 | 500 | 1000 |
| c(N2O5/mol/L) | 5.00 | 3.50 | 2.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
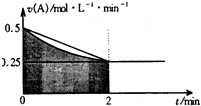 某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )
某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )| A. | 图中阴影部分的面积表示0-2min内A的物质的量浓度的减小值 | |
| B. | 反应开始的前2min,A的平均反应速率小于0.375mol•L-1•min-1 | |
| C. | 至2min时,A的物质的量减小值介于0.5mol至1mol之间 | |
| D. | 至2min时,c(B)介于1mol•L-1 至1.5mol•L-1 之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是人体不可缺少的营养物质 | |
| B. | 油脂的水解产物是氨基酸 | |
| C. | 油脂主要在小肠中被消化吸收 | |
| D. | 脂肪中多不饱和酸含量越高,其营养价值也越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉的作用是点燃时可以置换出氧气 | |
| B. | 在反应中NH4ClO4仅起到氧化剂作用 | |
| C. | 该反应属于分解反应,也属于氧化还原反应 | |
| D. | 上述反应瞬间能产生高温,高温是推动飞船飞行的主要因素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com