
| X | |
| Y | Z |
| A、X的气态氢化物热稳定性强于Z的气态氢化物 |
| B、原子半径:X<Y<Z |
| C、若Y的最高正价为+m,则X,Z的最高正价一定为+(m+1) |
| D、Y和Z的最高价氧化物对应水化物酸性Y>Z |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | 稀硫酸 | 铜 | 过滤 |
| B | CaSO4溶液 | 稀硫酸 | 过量CaCO3、过滤 |
| C | FeCl2溶液 | CuCl2 | 过量铁粉、过滤 |
| D | 二氧化碳 | 一氧化碳 | 点燃 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
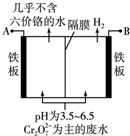 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法正确的是( )| A、A接电源负极 |
| B、阳极区溶液中发生的氧化还原反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
| C、阴极区附近溶液pH降低 |
| D、若不考虑气体的溶解,当收集到H213.44L(标准状况)时,有0.2mol Cr2O72-被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室的氯水需要保存在棕色试剂瓶中 |
| B、漂白粉比氯水稳定,可露置在空气中 |
| C、称量氢氧化钠固体时,可在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码 |
| D、金属钠可保存在煤油、四氯化碳等有机溶剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| B、用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 |
| C、石油的分馏是物理变化,而煤的干馏是化学变化 |
| D、将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使甲基橙变黄的溶液中:Na+、K+、SO42-、AlO2- |
| B、水电离产生的c(H+)=1×10-12mol/L溶液:CH3COOH、Na+、Cl-、I- |
| C、能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32- |
| D、0.1 mol?L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com