
ΓΨΧβΡΩΓΩAΓΔBΓΔCΓΔXΨυΈΣ÷–―ß≥ΘΦϊΒΡΈο÷ Θ§ΥϋΟ«÷°Φδ”–»γœ¬ΉΣΜ·ΙΊœΒ(Ζ¥”ΠΧθΦΰΦΑΗ±≤ζΈο“―¬‘»ΞΘ©ΓΘ
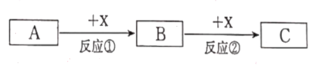
(1)»τAΚΆXΨυΈΣΒΞ÷ Θ§BΈΣΩ… ΙΤΖΚλ»ή“ΚΆ …ΪΒΡΤχΧεΘ§‘ρΖ¥”ΠΔΎΒΡΜ·―ßΖΫ≥Χ ΫΈΣ____ΓΘ
(2)»τAΓΔBΓΔCΈΣΚ§ΡΤ‘ΣΥΊΒΡΜ·ΚœΈοΘ§XΈΣΈό…ΪΈόΈΕΤχΧεΘ§‘ρΖ¥”ΠΔΎΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______ ΓΘ
(3)»τAΈΣœΓœθΥαΘ§B»ή“ΚΚΆΝρ«ηΥαΦΊ»ή“ΚΖ¥”ΠΚσ»ή“Κœ‘Κλ…ΪΘ§‘ρΖ¥”ΠΔΎΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_____ΓΘ»τœρCΒΡ»ή“Κ÷–Φ”»κ«β―θΜ·ΡΤ»ή“Κ≤ζ…ζΑΉ…Ϊ≥ΝΒμΘ§‘ΎΩ’Τχ÷–―ΗΥΌ±δ≥…_____Θ§ΉνΚσ±δ≥…_______Θ§ΑΉ…Ϊ≥ΝΒμΖΔ…ζ…œ ω±δΜ·ΒΡ‘≠“ρ ______(”ΟΜ·―ßΖΫ≥Χ Ϋ±μ Ψ)ΓΘ56 g X”κΉψΝΩΒΡœΓœθΥαΖΔ…ζΖ¥”ΠΘ§±ΜΜΙ‘≠ΒΡHNO3ΈΣ__________gΓΘ
ΓΨ¥πΑΗΓΩ![]()
![]()
![]() Μ“¬Χ…Ϊ ΚλΚ÷…Ϊ
Μ“¬Χ…Ϊ ΚλΚ÷…Ϊ ![]() 63
63
ΓΨΫβΈωΓΩ
(1)»τAΚΆXΨυΈΣΒΞ÷ Θ§BΈΣΩ… ΙΤΖΚλ»ή“ΚΆ …ΪΒΡΤχΧεΘ§B“ΜΕ® «SO2Θ§A «ΝρΘ§C «»ΐ―θΜ·ΝρΘ§X «―θΤχΘ§ΗΟΖ¥”Π «Ω…ΡφΖ¥”ΠΘΜ(2)»τAΓΔBΓΔCΈΣΚ§ΡΤ‘ΣΥΊΒΡΜ·ΚœΈοΘ§XΈΣΈό…ΪΈόΈΕΤχΧεΘ§AΝ§–χ”κXΖ¥”ΠΘ§AΩ…Ρή «―θΜ·ΡΤΘ§Ω…Ρή «Ιΐ―θΜ·ΡΤΘ§Ι B“ΜΕ® «ΧΦΥαΡΤΘ§C“ΜΕ® «ΧΦΥα«βΡΤΘΜ(3)»τAΈΣœΓœθΥαΘ§B»ή“ΚΚΆΝρ«ηΗυάκΉ”Ζ¥”ΠΚσ»ή“Κœ‘Κλ…ΪΘ§B“ΜΕ® «œθΥαΧζΘ§XΈΣΧζΘ§BΦΧ–χ”κΧζΖ¥”ΠΘ§ΖΔ…ζΦέΧ§Ιι÷–Ζ¥”ΠΘ§C «œθΥα―«ΧζΓΘ
(1)»τAΚΆXΨυΈΣΒΞ÷ Θ§BΈΣΩ… ΙΤΖΚλ»ή“ΚΆ …ΪΒΡΤχΧεΘ§B“ΜΕ® «SO2Θ§A «ΝρΘ§C «»ΐ―θΜ·ΝρΘ§X «―θΤχΘ§‘ρΖ¥”ΠΔΎΒΡΜ·―ßΖΫ≥Χ ΫΈΣΘΚ![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΘΜ
ΘΜ
(2)»τAΓΔBΓΔCΈΣΚ§ΡΤ‘ΣΥΊΒΡΜ·ΚœΈοΘ§XΈΣΈό…ΪΈόΈΕΤχΧεΘ§AΝ§–χ”κXΖ¥”ΠΘ§AΩ…Ρή «―θΜ·ΡΤΘ§Ω…Ρή «Ιΐ―θΜ·ΡΤΘ§Ι B“ΜΕ® «ΧΦΥαΡΤΘ§C“ΜΕ® «ΧΦΥα«βΡΤΘ§Ι Ζ¥”ΠΔΎΒΡΜ·―ßΖΫ≥Χ ΫΈΣΘΚ![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΘΜ
ΘΜ
(3)»τAΈΣœΓœθΥαΘ§B»ή“ΚΚΆΝρ«ηΗυάκΉ”Ζ¥”ΠΚσ»ή“Κœ‘Κλ…ΪΘ§B“ΜΕ® «œθΥαΧζΘ§XΈΣΧζΘ§BΦΧ–χ”κΧζΖ¥”ΠΘ§ΖΔ…ζΦέΧ§Ιι÷–Ζ¥”ΠΘ§C «œθΥα―«ΧζΘ§‘ρΖ¥”ΠΔΎΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ![]() ΘΜœρCΒΡ»ή“Κ÷–Φ”»κ«β―θΜ·ΡΤ»ή“Κ≤ζ…ζΑΉ…Ϊ≥ΝΒμ«β―θΜ·―«ΧζΘ§‘ΎΩ’Τχ÷–±Μ―θΜ·≥…«β―θΜ·ΧζΘ§―’…Ϊ”…ΑΉ…Ϊ±δ≥…Μ“¬Χ…ΪΘ§Ήν÷’±δ≥…ΚλΚ÷…ΪΘ§Ζ¥”ΠΖΫ≥Χ ΫΈΣΘΚ
ΘΜœρCΒΡ»ή“Κ÷–Φ”»κ«β―θΜ·ΡΤ»ή“Κ≤ζ…ζΑΉ…Ϊ≥ΝΒμ«β―θΜ·―«ΧζΘ§‘ΎΩ’Τχ÷–±Μ―θΜ·≥…«β―θΜ·ΧζΘ§―’…Ϊ”…ΑΉ…Ϊ±δ≥…Μ“¬Χ…ΪΘ§Ήν÷’±δ≥…ΚλΚ÷…ΪΘ§Ζ¥”ΠΖΫ≥Χ ΫΈΣΘΚ![]() ΘΜΧζ”κΉψΝΩΒΡœΓœθΥαΖΔ…ζΖ¥”ΠΘ§œθΥα±ΜΜΙ‘≠ΈΣ“Μ―θΜ·ΒΣΘ§άκΉ”ΖΫ≥Χ ΫΈΣΘΚ
ΘΜΧζ”κΉψΝΩΒΡœΓœθΥαΖΔ…ζΖ¥”ΠΘ§œθΥα±ΜΜΙ‘≠ΈΣ“Μ―θΜ·ΒΣΘ§άκΉ”ΖΫ≥Χ ΫΈΣΘΚ![]() ΘΜΧζ”κ±ΜΜΙ‘≠ΒΡœθΥαΈο÷ ΒΡΝΩ÷°±»ΈΣΘΚ1ΘΚ1Θ§Υυ“‘±ΜΜΙ‘≠ΒΡœθΥα÷ ΝΩΈΣΘΚ
ΘΜΧζ”κ±ΜΜΙ‘≠ΒΡœθΥαΈο÷ ΒΡΝΩ÷°±»ΈΣΘΚ1ΘΚ1Θ§Υυ“‘±ΜΜΙ‘≠ΒΡœθΥα÷ ΝΩΈΣΘΚ![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΘΜΜ“¬Χ…ΪΘΜΚλΚ÷…ΪΘΜ
ΘΜΜ“¬Χ…ΪΘΜΚλΚ÷…ΪΘΜ![]() ΘΜ63ΓΘ
ΘΜ63ΓΘ


 –Γ―ßΫΧ≤Ρ»Ϊ≤βœΒΝ–¥πΑΗ
–Γ―ßΫΧ≤Ρ»Ϊ≤βœΒΝ–¥πΑΗ –Γ―ß ΐ―ßΩΎΥψΧβΩ®Ά―ΩΎΕχ≥ωœΒΝ–¥πΑΗ
–Γ―ß ΐ―ßΩΎΥψΧβΩ®Ά―ΩΎΕχ≥ωœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΫΪV 1 mL 0.1molΓΛL-1ΒΡFe2(SO4)3»ή“Κ”κ2mL 0.1molΓΛL-1KI»ή“ΚΜλΚœΘ§¥ΐ≥δΖ÷Ζ¥”ΠΚσΘ§œ¬Ν–ΖΫΖ®Ω…÷ΛΟςΗΟΖ¥”ΠΨΏ”–“ΜΕ®œόΕ»ΒΡ «Θ® Θ©
A.»τV1<1Θ§Φ”»κΒμΖέB.»τV1Γή1Θ§Φ”»κKSCN»ή“Κ
C.»τV1Γί1Θ§Φ”»κAgNO3»ή“ΚD.Φ”»κBa(NO3)2»ή“Κ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈΣΝΥΖά÷Ι«Ι÷ß…ζ–βΘ§≥Θ≤…”ΟΜ·―ߥΠάμ Ι«Ι÷ßΒΡΗ÷ΧζΝψΦΰ±μΟφ…ζ≥…Fe3O4ΒΡ÷¬Οή±ΘΜΛ≤ψΓΣ ΓΑΖΔάΕΓ±ΓΘΜ·―ߥΠάμΙΐ≥Χ÷–Θ§Τδ÷–“Μ≤ΫΖ¥”ΠΈΣ3Fe + NaNO2+5NaOH =3Na2FeO2+H2O+NH3ΓϋΓΘœ¬Ν––π ω≤Μ’ΐ»ΖΒΡ «
A.ΗΟ¥ΠάμΙΐ≥Χ≤ΜΜα≤ζ…ζΈέ»ΨB.…œ ωΖ¥”Π÷–Χζ±Μ―θΜ·
C.NO2-ΒΡ―θΜ·–‘¥σ”ΎFeO22-D.Ζ¥”Π÷–ΉΣ“Τ2mole-Θ§…ζ≥…ΜΙ‘≠≤ζΈο![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ2AΘ®gΘ©+B(g)![]() 3C(g)+4D(g)Ζ¥”Π÷–Θ§±μ ΨΗΟΖ¥”ΠΥΌ¬ ΉνΩλΒΡ «Θ® Θ©
3C(g)+4D(g)Ζ¥”Π÷–Θ§±μ ΨΗΟΖ¥”ΠΥΌ¬ ΉνΩλΒΡ «Θ® Θ©
A. vΘ®BΘ©=0.3mol/(LΓΛ s) B. vΘ®AΘ©=0.5mol/(LΓΛ min)
C. vΘ®CΘ©=0.8mol/(LΓΛ s) D. vΘ®DΘ©=1mol/(LΓΛ min)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΆ≠Αε…œΧζΟ≠ΕΛ¥ΠΒΡΈϋ―θΗ· ¥‘≠άμ»γΆΦΥυ ΨΘ§œ¬Ν–”–ΙΊΥΒΖ®’ΐ»ΖΒΡ «
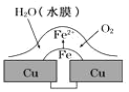
A.―τΦΪΒγΦΪΖ¥”Π ΫΈΣΘΚ2H++2eΓζH2Γϋ
B.¥ΥΙΐ≥Χ÷–ΒγΉ”¥” Fe “Τœρ CuΘ§ΧζΟ≠ΕΛΖΔ…ζΜΙ‘≠Ζ¥”Π
C.¥ΥΙΐ≥Χ÷–Ά≠Μα±ΜΗ· ¥Θ§ΖΔ…ζ―θΜ·Ζ¥”Π
D.¥ΥΙΐ≥Χ÷–ΧζΉωΗΚΦΪΘ§±Μ―θΜ·
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘ΎΩ…ΡφΖ¥”Π2A(g)+3B(g)![]() xCΘ®gΘ©ΘΪDΘ®gΘ©÷–Θ§“―÷ΣΘΚΖ¥”ΠΩΣ ΦΦ”»κΒΡΈο÷ ÷Μ”– AΓΔBΘ§Τπ Φ≈®Ε» A ΈΣ 5 molΓΛL-1Θ§B ΈΣ 3 molΓΛL-1Θ§«Α 2 min C ΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΈΣ 0.5 molΓΛL-1ΓΛmin-1,2 min ΚσΘ§≤βΒΟ D ΒΡ≈®Ε»ΈΣ 0.5molΓΛL-1Θ§‘ρΙΊ”Ύ¥ΥΖ¥”ΠΒΡœ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «Θ® Θ©
xCΘ®gΘ©ΘΪDΘ®gΘ©÷–Θ§“―÷ΣΘΚΖ¥”ΠΩΣ ΦΦ”»κΒΡΈο÷ ÷Μ”– AΓΔBΘ§Τπ Φ≈®Ε» A ΈΣ 5 molΓΛL-1Θ§B ΈΣ 3 molΓΛL-1Θ§«Α 2 min C ΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΈΣ 0.5 molΓΛL-1ΓΛmin-1,2 min ΚσΘ§≤βΒΟ D ΒΡ≈®Ε»ΈΣ 0.5molΓΛL-1Θ§‘ρΙΊ”Ύ¥ΥΖ¥”ΠΒΡœ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «Θ® Θ©
A.2 min Ρ© ± A ΚΆ B ΒΡ≈®Ε»÷°±»ΈΣ 5ΓΟ3
B.xΘΫ1
C.2 min Ρ© ± A œϊΚΡΒΡ≈®Ε»ΈΣ 0.5 molΓΛL-1
D.2 min Ρ© ± B ΒΡ≈®Ε»ΈΣ 1.5 molΓΛL-1
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ≥Θ―Ιœ¬τ ΜυΜ·Ζ®ΨΪΝΕΡχΒΡ‘≠άμΈΣ: Ni(s)+4CO(g) ![]() Ni(CO)4(g)ΓΘ230Γφ ±Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐK=2ΓΝ105ΓΘ“―÷ΣΘΚNi(CO)4ΒΡΖ–ΒψΈΣ42.2ΓφΘ§ΙΧΧε‘”÷ ≤Μ≤Έ”κΖ¥”ΠΓΘ
Ni(CO)4(g)ΓΘ230Γφ ±Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐK=2ΓΝ105ΓΘ“―÷ΣΘΚNi(CO)4ΒΡΖ–ΒψΈΣ42.2ΓφΘ§ΙΧΧε‘”÷ ≤Μ≤Έ”κΖ¥”ΠΓΘ
ΒΎ“ΜΫΉΕΈΘΚΫΪ¥÷Ρχ”κCOΖ¥”ΠΉΣΜ·≥…ΤχΧ§Ni(CO)4ΘΜ
ΒΎΕΰΫΉΕΈΘΚΫΪΒΎ“ΜΫΉΕΈΖ¥”ΠΚσΒΡΤχΧεΖ÷άκ≥ωά¥Θ§Φ”»»÷Ν230Γφ÷ΤΒΟΗΏ¥ΩΡχΓΘ
œ¬Ν–≈–Εœ≤Μ’ΐ»ΖΒΡ «
A. ΗΟΖ¥”Π¥οΒΫΤΫΚβ ±Θ§vΖ÷Ϋβ[Ni(CO)4]=4vœϊΚΡ(CO)
B. ΒΎ“ΜΫΉΕΈ”Π―Γ‘ώ…‘ΗΏ”Ύ42.2ΓφΒΡΖ¥”ΠΈ¬Ε»
C. ΒΎΕΰΫΉΕΈ,230Γφ ±Ni(CO)4Ζ÷Ϋβ¬ ΫœΗΏ
D. ΤδΥϊΧθΦΰ≤Μ±δΘ§‘ωΦ”c(CO),ΤΫΚβœρ’ΐœρ“ΤΕ·,Ζ¥”ΠΒΡΤΫΚβ≥Θ ΐ≤Μ±δ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩKBrΩ…”Ο”ΎΙβΤΉΖ÷ΈωΚΆΜ·―ßΖ÷ΈωΒ»ΓΘ
(1)÷Τ±ΗKBrΒΡ“Μ÷÷ΖΫΖ®»γœ¬ΘΚ80Γφ ±Θ§œρ»ή”–CO(NH2)2ΒΡKOH»ή“Κ÷–ΜΚ¬ΐΦ”»κBr2Θ§÷ΝpHΈΣ6ΓΪ7 ±Ζ¥”ΠΆξ»ΪΘ§…ζ≥…CO2ΓΔN2Β»ΓΘΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_____ΓΘ
(2)KBrΩ…”Ο”Ύ≤βΕ®±ΫΖ”(C6H5OH)―υΤΖΒΡ¥ΩΕ»Θ§ΖΫΖ®»γœ¬ΘΚ»Γ0.5000g±ΫΖ” ‘―υΘ§”ΟNaOH»ή“Κ»ήΫβΚσΕ®»ί≥…250.00mL»ή“ΚΘΜ“Τ»Γ25.00mLΗΟ»ή“ΚΘ§Φ”»κ25.00mL0.03000molL©¹1ΒΡKBrO3(Κ§ΙΐΝΩKBr)±ξΉΦ»ή“ΚΘ§»ΜΚσΦ”»κΉψΝΩ―ΈΥαΘ§≥δΖ÷Ζ¥”ΠΚσ‘ΌΦ”ΉψΝΩKI»ή“ΚΘ§≥δΖ÷Ζ¥”ΠΘΜ”Ο0.1000molL©¹1Na2S2O3»ή“ΚΒΈΕ®÷ΝΒ≠ΜΤ…ΪΘ§Φ”»κ÷Η ΨΦΝΘ§ΦΧ–χΒΈΕ®÷Ν÷’ΒψΘ§”Ο»Ξ16.20mLΓΘ≤βΕ®Ιΐ≥Χ÷–Έο÷ ΒΡΉΣΜ·ΙΊœΒ»γœ¬ΘΚ

ΔΌΦ”»κΒΡ÷Η ΨΦΝΈΣ_____ΓΘ
ΔΎΦΤΥψ±ΫΖ”―υΤΖΒΡ¥ΩΕ»(–¥≥ωΦΤΥψΙΐ≥Χ)_____ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ
”–ΜζΈοA «ΨέΚœΖ¥”Π…ζ≤ζΫΚπΛΦΝΜυΝœΒΡΒΞΧεΘ§“ύΩ…ΉςΈΣΚœ≥…ΒςœψΦΝIΓΔΨέθΞ≤ΡΝœJΒΡ‘≠ΝœΘ§œύΙΊΚœ≥…¬ΖœΏ»γœ¬ΘΚ

“―÷ΣΘΚ‘Ύ÷ ΤΉΆΦ÷–ΧΰAΒΡΉν¥σ÷ Κ…±»ΈΣ118Θ§EΒΡΫαΙΙΦρ ΫΈΣΘΚ
ΗυΨί“‘…œ–≈œΔΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ© AΒΡΖ÷Ή” ΫΈΣ___________Θ§AΥυΚ§ΒΡΙΌΡήΆ≈Οϊ≥ΤΈΣ____________Θ§EΓζFΒΡΖ¥”Πάύ–ΆΈΣ___________ΓΘ
Θ®2Θ© IΒΡΫαΙΙΦρ ΫΈΣ__________________________Θ§
Θ®3Θ© D”κ–¬÷Τ«β―θΜ·Ά≠–ϋΉ«“ΚΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ________________________________ΓΘ
Θ®4Θ© HΒΡΆ§Ζ÷“λΙΙΧεWΡή”κ≈®δεΥ°Ζ¥”Π≤ζ…ζΑΉ…Ϊ≥ΝΒμΘ§1 mol W≤Έ”κΖ¥”ΠΉνΕύœϊΚΡ3 mol Br2Θ§«κ–¥≥ωΥυ”–ΖϊΚœΧθΦΰΒΡWΒΡΫαΙΙΦρ Ϋ_____________________________________ΓΘ
Θ®5Θ© J «“Μ÷÷ΗΏΖ÷Ή”Μ·ΚœΈοΘ§‘ρ”…C…ζ≥…JΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_______________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com